O prawie izohydrii i buforowaniu równowagi kwasowo-zasadowej organizmu (równowagi H+/HCO3–) pisałem już wcześniej. Zamknięcie tego zagadnienia wymaga jednak przyjrzenia się jego regulacjom – w szczególności roli, jaka w tych regulacjach przypada nerkom.
Pierwszym etapem kontrolowania i przywracania równowagi H+/HCO3– jest buforowanie chemiczne (+ rozcieńczanie), zachodzące przy współudziale buforów wodorowęglanowego i hemoglobinowego w osoczu krwi. Przypomnimy schemat zmian stanów hemoglobiny:
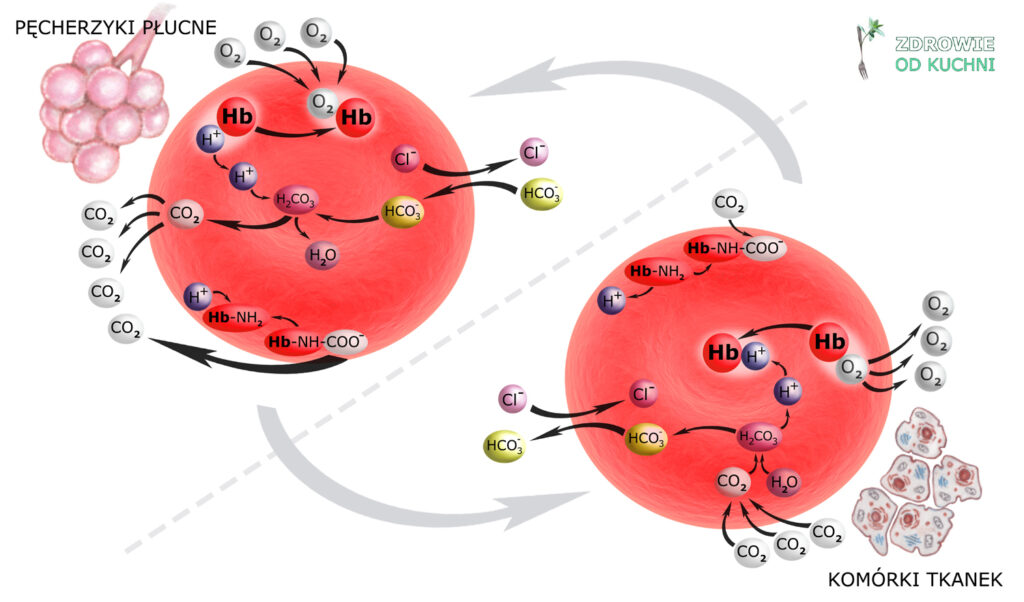
oraz schemat struktury otwartego buforu wodorowęglanowego:
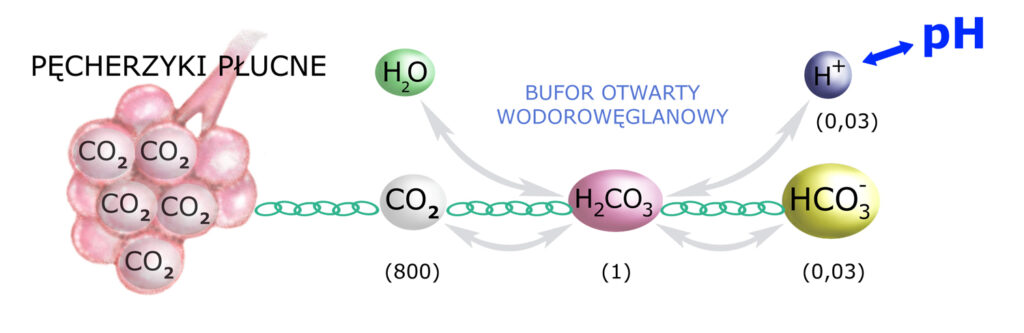
Buforowanie chemiczne zachodzi szybko, w ciągu zaledwie kilku minut, przy czym należy pamiętać, że prócz osocza obejmuje ono także śródmiąższ tkanek – dzięki mechanizmowi rozcieńczania, czyli rozprowadzania H+/HCO3– po całej przestrzeni pozakomórkowej.
W chwili, gdy buforowanie chemiczne przestaje wystarczać, organizm uruchamia buforowanie biologiczne, a więc przestrzeń wewnątrzkomórkową. Trwa to już dłużej, kilka godzin, podczas których zaburzenia równowagi H+/HCO3– ‘pacyfikowane’ są też pojemnością buforów białczanowego i fosforanowego wnętrz komórek.
Przedostające się do wnętrz komórek jony H+ muszą – zgodnie z zasadą elektroobojętności – wyprzeć z cytoplazmy jakiś inny kation. Jako że głównym kationem wnętrz komórek jest K+, efektem buforowania biologicznego jest więc zawsze pojawienie się większych ilości K+ w płynie pozakomórkowym. I to jest właśnie sygnał uruchamiający buforowanie fizjologiczne, czyli NERKĘ.
Przypomnijmy sobie schemat, który był konkluzją opracowania dotyczącego buforowania równowagi H+/HCO3–:
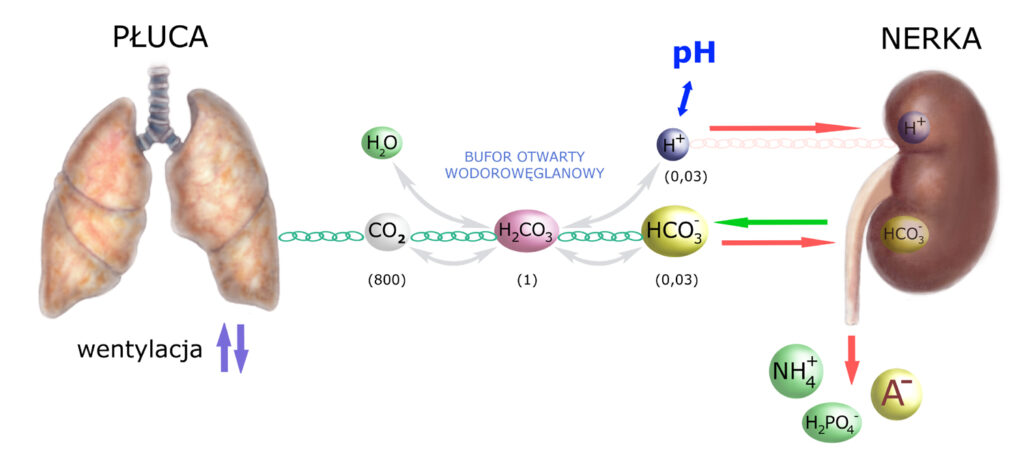
Spróbujmy podsumować to, co widzimy powyżej, pozbywając się dowolnych uprzedzeń i dowolnych założeń wstępnych (zwykle drzemiących w naszej podświadomości jako ślady ‘mentalnej tresury’).
Sercem układu równowagi H+/HCO3– jest – całkiem po prostu – kwas węglowy H2CO3. Przez cały czas znajduje się on w sztywnej równowadze zarówno z cząsteczkami CO2 i H2O (na które rozkłada się chemicznie) jaki i jonami H+ i HCO3– (na które dysocjuje). Cząsteczki CO2 i H2O mogą być usuwane przez płuca (dwutlenek węgla, para wodna), natomiast H+ i HCO3– oraz H2O – przez nerki (mocz).
Buforowanie fizjologiczne jest ostatecznym etapem kontrolowania i przywracania równowagi H+/HCO3–, gdyż na tym etapie dochodzi do usuwania zbędnych lub odtwarzania utraconych elementów układu. Buforowanie to obejmuje więc skrajnie położone obszary schematu – układ oddechowy i nerki.
Zauważ jednak, iż zakres regulacji leżący po stronie płuc jest w tej mierze stosunkowo niewielki: płuca dysponują raptem jednym mechanizmem – szybkością wentylacji. Częstość i głębokość oddechów normują stężenie CO2 we krwi, ale przecież krew to zaledwie cząstka całej pojemności buforowej organizmu. Szacuje się, że ~55% tej pojemności przypada na płyn wewnątrzkomórkowy, dalsze ~30% na płyn śródmiąższowy, a na osocze – reszta, przy czym te pozostałe 15-20% to zarówno cząsteczki CO2/H2O jak i jony H+/HCO3–. Już sama analiza tych proporcji zmusza nas do konkluzji, że:
Głównym Narządem Regulującym
i Przywracającym Równowagę H+/HCO3–
jest NERKA
Układ oddechowy – owszem – jest niezastąpiony w codziennej, mozolnej współpracy z buforami chemicznymi, gdyż dla regulacji ich pracy szybkie zmiany stężenia CO2 we krwi są adekwatne i wystarczające. Gdy jednak w naszym organizmie dzieje się coś znaczącego, co angażuje pojemność buforową wszystkich przestrzeni organizm – do głosu musi dojść narząd kontrolujący poziomy H+ i HCO3–, a więc mogący zarówno usuwać jak i odtwarzać zasoby tych jonów.
I taka jest właśnie rola nerek (!).
Procesy resorpcji HCO3– i sekrecji H+ są ze sobą wzajemnie powiązane i zachodzą na poziomie kanalików nerkowych.
Przypominam, że najczęstszą, najbardziej powszechną, najchętniej marginalizowaną i najodważniej lekceważoną przyczyną zakwaszenia organizmu jest nadmiar białka w diecie. Jako że jedynie nerki potrafią pozbywać się jonów wodorowych, na co dzień cały nadmiar pochłanianego przez nas kwasu – wydalany jest w moczu.
Szacuje się, że średni dobowy nadmiar białka (zwierzęcego) spożywanego przez standardowego wszystkożercę wynosi ~60 mmol/24h. ‘Upakowanie’ jonów H+ odpowiadających tej ilości białka w dobowej objętości moczu spowodowałoby jego zakwaszenie do wartości pH od 1 do 2. Nasze nerki jednak nie są w stanie zakwasić moczu kanalikowego do wartości poniżej pH 4,5 (najczęściej pH moczu wynosi 6,5). W związku z tym tylko niewielka ilość wodoru wydalana jest w formie zjonizowanej (wolnej), natomiast większość – w formie związanej (zbuforowanej).
Opowieść o regulacji nerkowej rozpocznijmy od wodorowęglanów.
Regeneracja
Wodorowęglanów
Główna zasada ustrojowa – HCO3– – filtruje się w kłębuszkach nerkowych bez najmniejszych przeszkód. Aby nie doprowadzić do śmierci organizmu – kanaliki natychmiast przystępują do odzyskiwania (resorbowania) wodorowęglanów. W krótkim czasie w zasadzie wszystkie przefiltrowane HCO3– powracają do krwi:
80% – w kanaliku bliższym
10-15% – w pętli nefronu
reszta – w kanaliku dalszymi i zbiorczym
Tak naprawdę odzyskiwanie HCO3– nie ma jednak charakteru zwykłej resorpcji, ale raczej regeneracji. Chodzi o to, że kanaliki nie muszą wykorzystywać konkretnego przenośnika przerzucającego konkretny jon HCO3– przez błony komórkowe. Zamiast tego syntezują lub rozbijają cząsteczki kwasu węglowego po różnych stronach błon i – wykorzystując ruch jonów sodu – przerzucają wodór przez błonę luminalną (antyport Na+/H+) a wodorowęglany – przez antyluminalną (symport Na+/HCO3–).
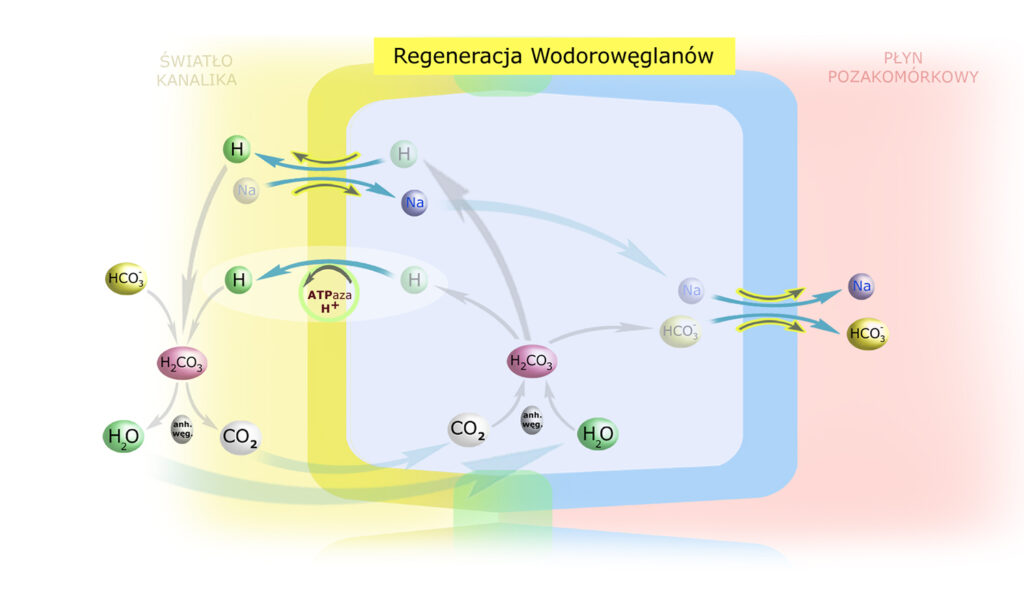
Na powyższym rysunku zaznaczono jedynie elementy uczestniczące w omawianym procesie.
Z wydalonego do światła kanalika protonu (wodoru) oraz wodorowęglanu – pochodzącego od przesączonej w kłębuszkach zasady) – powstaje kwas węglowy. Anhydraza węglanowa – obecna w przesączu jedynie w świetle kanalików bliższych – przyspiesza rozpad kwasu na dwutlenek węgla i wodę. Wewnątrz komórek ścian kanalików anhydraza (a tu jest ona obecna zawsze – we wszystkich odcinkach nefronu) katalizuje powstanie kwasu węglowego z CO2 i H2O, które dyfundowały ze światła kanalika do komórki. Dysocjując wewnątrz komórki – kwas węglowy odtwarza (regeneruje) H+ i HCO3– w cytoplazmie.
Jak widać na schemacie, w procesie regeneracji wodorowęglanu NIE dochodzi do usunięcia wodoru z organizmu.
Wydalanie Wodoru
Bufor HPO42-/H2PO4–
Układ fosforan dwuzasadowy – fosforan jednozasadowy jest drugim buforem przesączu kłębuszkowego.
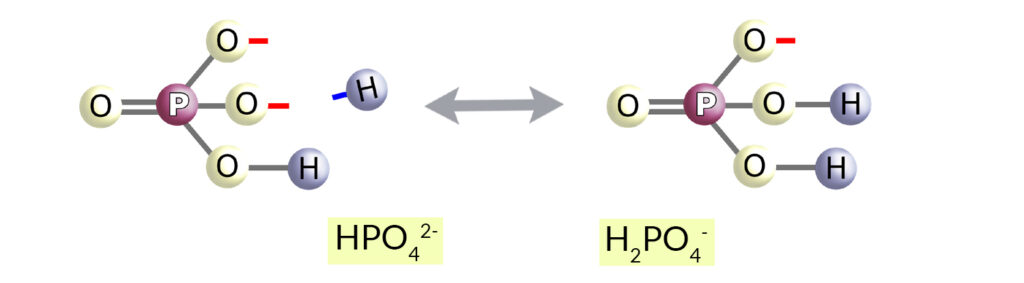
75% fosforanu dwuzasadowego obecnego w przesączu jest resorbowane, ale pozostałe 25% – może akceptować wodory (zamieniając się w fosforan jednozasadowy) i być w tej formie wydalone wraz z moczem.
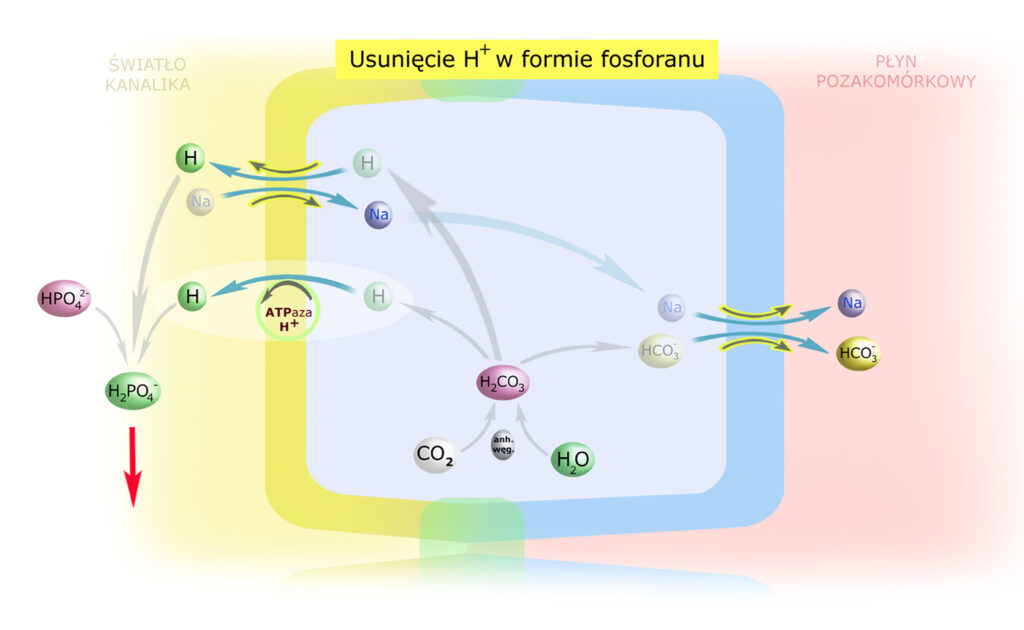
Tak więc w tym przypadku – w przeciwieństwie do procesu regeneracji wodorowęglanów – następuje wydalenie wodoru z organizmu, co jest równoznaczne z wytworzeniem jednego wodorowęglanu i przekazania go do krwi.
Wydalenie H+ = Wytworzenie HCO3–
W kanalikach bliższych przeważa proces regeneracji wodorowęglanów (stąd obecność anhydrazy węglanowej w świetle kanalików), dlatego pH przesączu na tej wysokości nefronu zmienia się nieznacznie. Buforowanie H+ przez fosforany ma miejsce dopiero w kanalikach dalszych. W ten sposób nerki mogą wydalić ~30 mmoli H+ w ciągu doby, a więc ilość odpowiadającą połowie spożytego (przez wszystkożercę) białka. Cała reszta H+ usuwana jest z wykorzystaniem jonu amonowego NH4+.
Wydalanie Wodoru
w Formie NH4+
Poniższy rysunek zawiera różne koncepcje pozbywania się wodoru wraz jonem amonowym.
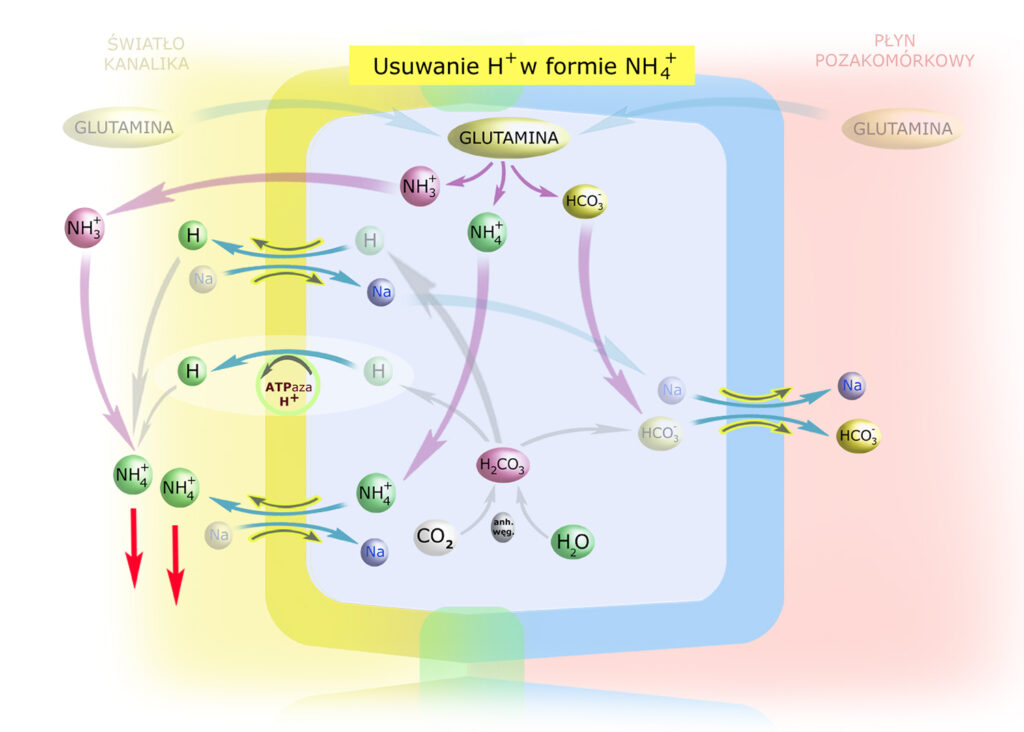
Glutamina dyfunduje do komórki zarówno z przesączu jak i z krwi. Jej katabolizm dostarcza amoniaku (NH3) i jonu amonowego (NH4+) oraz wodorowęglanów (HCO3–). Jony HCO3– transportowane są do śródmiąższu i krwi, a NH3 i NH4+ – do światła kanalika. Znalazłszy się w kanaliku, NH3 akceptuje protony dostarczone przez przenośniki błony luminalnej, zaminia się w NH4+ i zostaje usuwany z moczem.
Natężenie amonogenezy zależy od stanu zakwaszenia organizmu; w przypadku kwasicy wydalanie protonów w postaci NH4+ zwiększa się wielokrotnie.
Ważnym ogniwem regulacji równowagi H+/HCO3– jest taktyka odzyskiwania wodorowęglanów: czy zachodzi ono jedynie w trybie regeneracji HCO3–, a więc bez usuwania H+ czy też w trybie sekrecji kanalikowej protonów, czyli z usuwaniem H+ wraz z fosforanem (H2PO4–) i jonem amonowym (NH4+).
Sekrecja kanalikowa protonów zależy też od… pCO2 (prężności CO2) w osoczu. Jeśli zwiększa się zawartość CO2 we krwi, czyli mamy do czynienia z kwasicą oddechową – wydalanie wodorów rośnie. Jak się domyślasz, w przypadku alkalozy oddechowej, a więc zmniejszenia się pCO2 osocza – wydalanie wodorów spada.
Powyższa zależność pokazuje czynnościowe sprzężenie dwóch ramion buforowania fizjologicznego: z jednej strony CO2, z drugiej HCO3–.
Przypomnijmy sobie schemat jeszcze raz:

Gaz rozpuszczony w fazie wodnej pozostaje w równowadze z tym w fazie gazowej. Jeśli więc (z dowolnej przyczyny) płuca nie nadążają z usuwaniem dwutlenku węgla, powoduje to zwiększenie pCO2 w osoczu. Rozpuszczony CO2 pozostaje w równowadze z kwasem węglowym, w układzie wzrośnie więc i ilość H2CO3. To z kolei – dzięki stałej dysocjacji – prowadzi do zwiększenia się ilości jonów, na które H2CO3 dysocjuje, a więc też zwiększenia siły jonów wodorowych – czyli spadku pH (bo pH to logarytm ujemny).
Dlatego wzrost pCO2 w osoczu to tzw. kwasica oddechowa.
A przy kwasicy – dowolnej proweniencji – zawsze wzrasta sekrecja jonów H+ i usuwaniu ich pod postaciami H2PO4– i NH4+, umożliwiając pełną regenerację filtrowanych wodorowęglanów a także dodawanie nowych.
Natomiast(!):
Gdy organizm jest w stanie alkalozy (wysokie stężenie HCO3– w osoczu) spada sekrecja kanalikowa wodoru, co powoduje, że nie wszystkie filtrowane wodorowęglany są regenerowane; wodory nie wiążą się też z HPO42- i mocz przestaje być kwaśny (tzw. ‘kwaśność miareczkowa’), co oznacza, że nie powstają nowe jony HCO3–.
Zakwaszenie płynu pozakomórkowego – prócz zwiększenia sekrecji H+ do moczu kanalikowego – powoduje też wzrost katabolizmu glutaminy. Niezależnie od tego zwiększa się też wydalanie do moczu jonów NH4+ (czyli synteza nowych wodorowęglanów).
Analogicznie – alkalizacja przestrzeni pozakomórkowej powoduje efekty odwrotne.
* *
Fenomen Kwasu Węglowego
Zanim pokuszę się o dietetyczne konkluzje płynące z analizy mechanizmów bilansowania równowagi pomiędzy kwasami i zasadami w przestrzeniach naszego organizmu, chcę zwrócić uwagę na pewną biochemiczną… osobliwość – wręcz kuriozum: kwas węglowy.
Przede wszystkim – kwas węglowy (H2CO3) to efekt połączenia dwutlenku węgla i wody. H2O i CO2 mogą też być produktami rozkładu H2CO3. (Przy okazji warto sobie przypomnieć, że co 800-tna cząsteczka CO2 rozpuszczonego w naszych płynach ustrojowych – łączy się z H2O tworząc H2CO3).
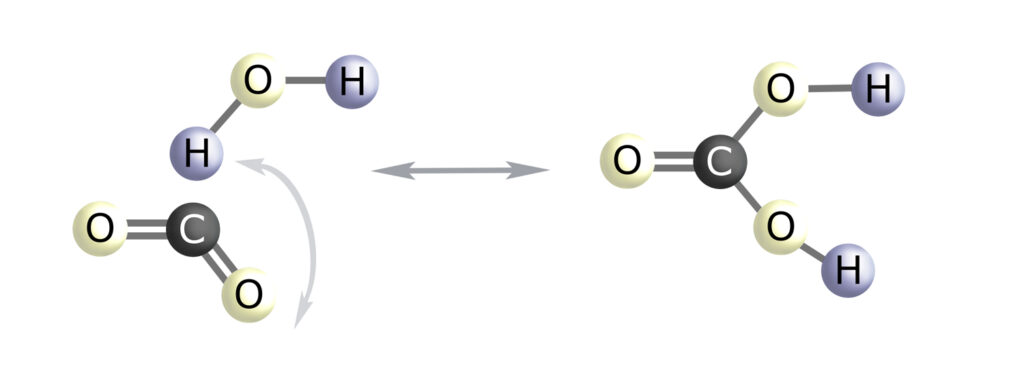
Kwas węglowy (H2CO3) dysocjuje na oba (!) nasze elementarne jony układowe – anion wodorowęglanowy (HCO3–) i kation wodoru (H+). Proporcje tych dwóch jonów układowych stanowią istotę tzw. równowagi kwasowo-zasadowej, którą w związku z powyższym można rozumieć jako równowagę H+/HCO3–. Jak pamiętamy – zgodnie ze stałą dysocjacji dla kwasu węglowego – na H+ i HCO3– dysocjuje co 33-cia cząsteczka H2CO3 (proporcja: 1/0,03).
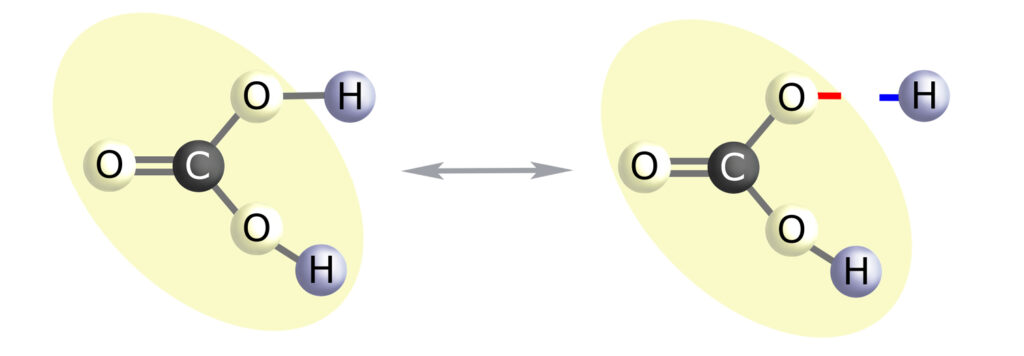
Ważne jest też to, że co 50-ta cząsteczka H2O dysocjuje na jony OH– i H+ (dokładna proporcja to 1000/18) – ta relacja odpowiada pH 7.
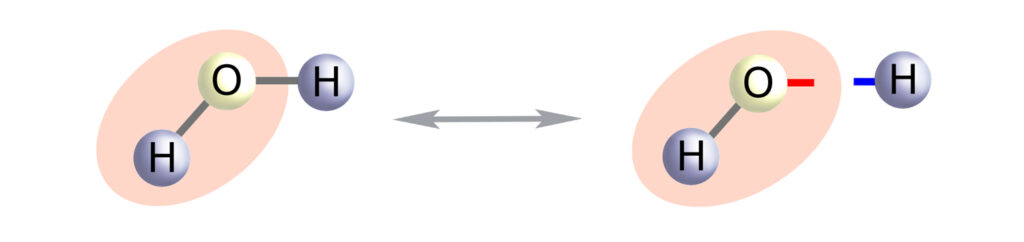
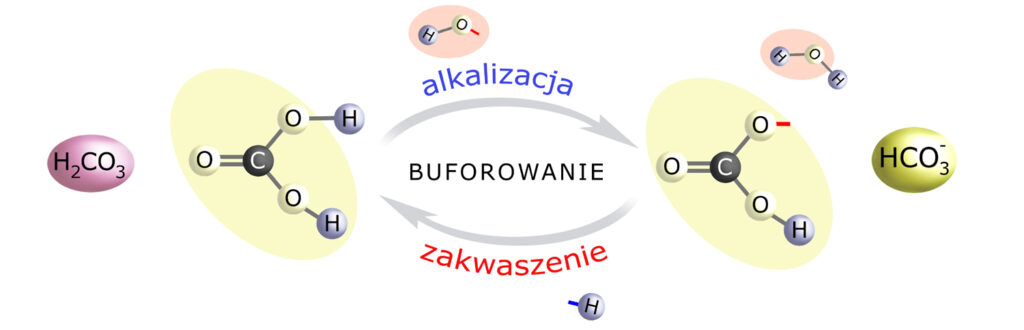
Teraz przyjrzyjmy się zdysocjowanym cząsteczkom H2CO3 i H2O a także schematom cząsteczek kwasu i zasady:
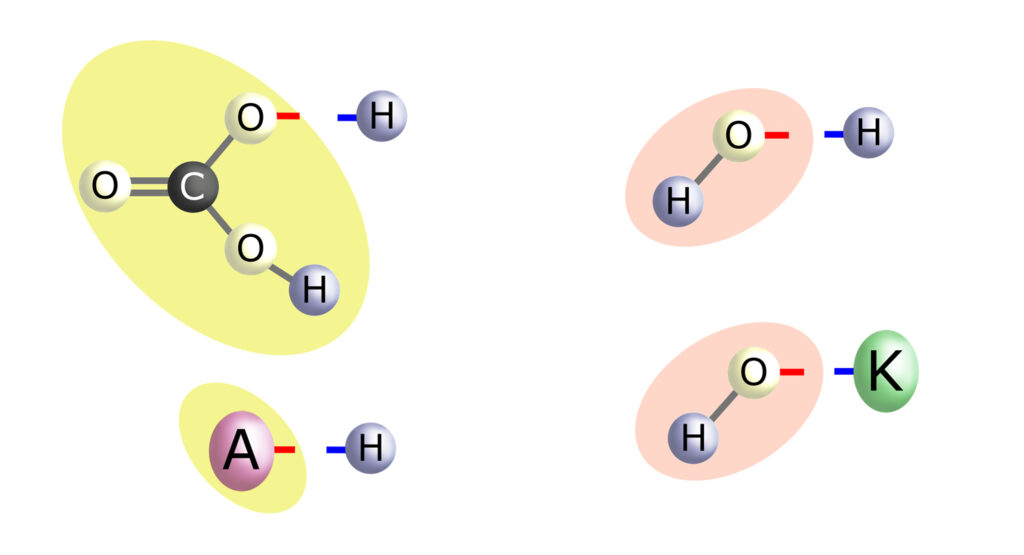
To nie jest przypadek.
Anion kwasu węglowego – wodorowęglan – ‘wymieni się’ z anionem dowolnego innego ‘obcego’ kwasu, który znajdzie się w naszym organizmie. Przez to neutralizuje (buforuje) ten kwas, gdyż łącząc się z jego wodorem – zamienia się w H2CO3. Jeśli był to kwas silny, to teraz zamienił się w słaby, z którym nasz organizm radzi sobie doskonale (dzięki płucom lub nerkom). Po obcym kwasie pozostaje tylko obcy anion, który ulega wydaleniu wraz z moczem.
Co do wody:
Z pewnego punku widzenia woda to przecież nic innego jak zasada wodorowa (albo kwas wodorotlenowy). Cząsteczka wody dysocjuje na kation wodoru (a więc kwintesencję kwasu) i anion wodorotlenowy (czyli kwintesencję zasady).
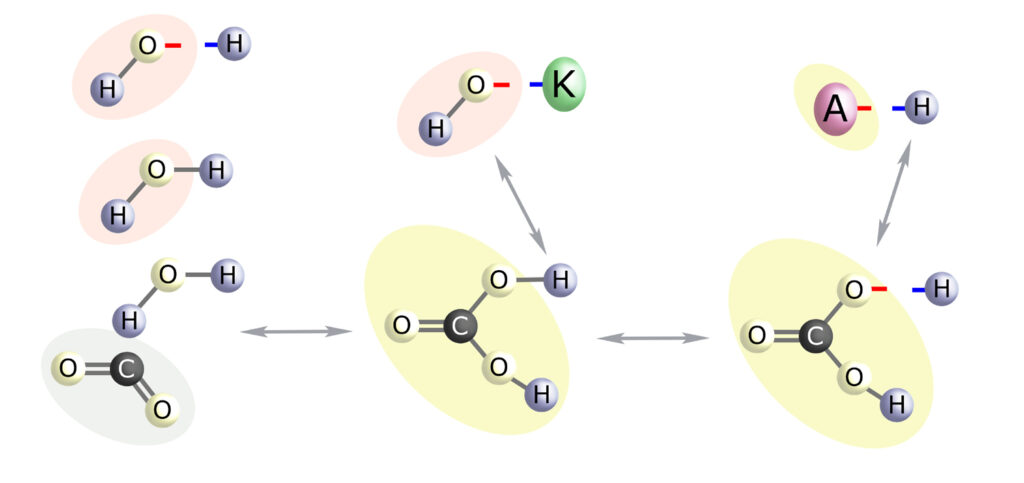
Grupa wodorotlenowa, bez względu na to skąd pochodzi, napotykając na cząsteczkę kwasu węglowego – odbierze jej wodór, zmieniając ją w wodorowęglan, a siebie w wodę.
Podsumowując:
– zakwaszenie (nadmiar H+) buforowany jest przez transformację HCO3– do H2CO3
– alkalizacja (nadmiar OH–) buforowana jest przez transformację H2CO3 do HCO3–.
* *

