Tematyka ‘roli wody w organizmie’ jest bogato eksploatowana w medycznej literaturze i nie ma sensu tego powielać. To, czego zwykle brakuje w większości opracowań to spojrzenie biochemiczne i odpowiedź na pytania: Jaką substancją jest woda? Jakie są jej cechy fizyko-chemiczne? Jaka jest natura środowiska wodnego i jak wpływa ona na wszystkie inne substancje organizmu?
O każdej substancji można powiedzieć, że posiada pewien ‘potencjał chemiczny’, będący jej własną, charakterystyczną dla tej substancji energią wewnętrzną. W przypadku wody potencjał ten w ogromnej mierze zależy od relacji międzycząsteczkowych, do których należą oddziaływania typu ‘TRWAŁY DIPOL – TRWAŁY DIPOL ’ oraz tzw. WIĄZANIA WODOROWE.
Cząsteczka wody powstaje przez kowalencyjne połączenie jednego atomu tlenu z dwoma atomami wodoru, przy czym wodory lokalizują się niejako po tej samej stronie atomu tlenu (oddzielone od siebie kątem ~105 stopni).

Jako że atom tlenu naładowany jest ujemnie, a atomy wodoru dodatnio – cząsteczka wody posiada więc dwa bieguny (di-polos), czyli jest dipolem. Z jednej strony cząsteczki – od strony tlenu – przewagę ma ładunek ujemny, a po stronie przeciwnej – od strony wodorów – występuje nadmiar ładunku dodatniego. Każda z cząsteczek wody posiada więc dwa własne bieguny magnetyczne o trwałym charakterze (posiadają tzw. ‘trwały moment dipolowy’).
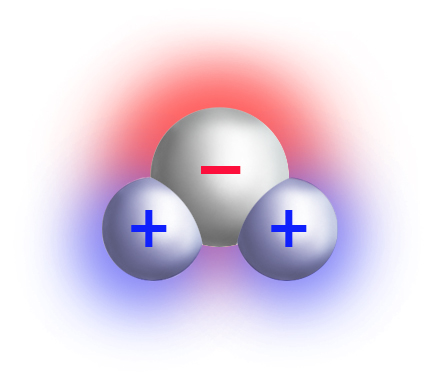
Jeśli wiele takich trwałych cząsteczek-dipoli znajdzie się obok siebie – wszystkie na siebie wzajemnie oddziałują: ich bieguny jednoimienne – odpychają się, a różnoimienne – przyciągają. Dzięki tym oddziaływaniom (dipol-dipol) woda zyskuje swój ‘charakter’ – jako substancja.

Inną cechą przydającą wodzie niepowtarzalnego charakteru (gęstości) są tzw. wiązania wodorowe (tzw. mostki wodorowe). Powstają one wtedy, gdy dwie cząsteczki wody zbliżą się do siebie tak, że biegun ujemny jednej z nich (atom tlenu) sąsiaduje z biegunem dodatnim (atom wodoru) drugiej z cząsteczek. W takim wypadku mamy sytuację, w której wodór (związany kowalencyjnie z tlenem swojej cząsteczki) zaczyna być przyciągany (magnetycznie) przez tlen innej cząsteczki,. Wodór ten jest niejako ‘współdzielony’ przez atomy tlenu dwóch sąsiednich cząsteczek wody, przy czym wiązania kowalencyjne są silne, a wiązania magnetyczne – słabe i nietrwałe.
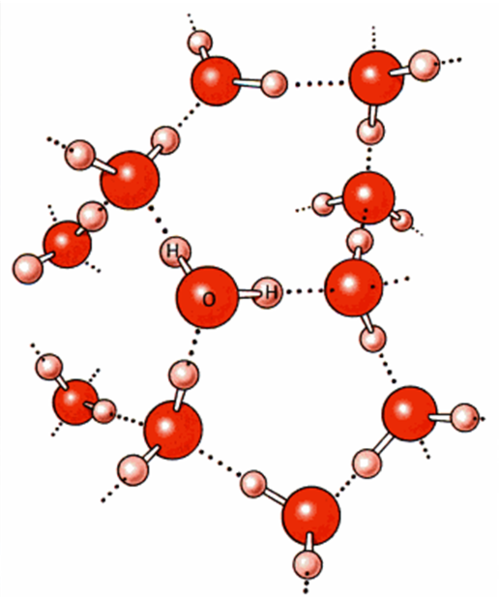
Gdy woda jest w stanie ciekłym mostki wodorowe powstają i rozpadają się nieustannie. Mówi się o nich, że posiadają potrójną naturę, a więc że charakteryzuje je 3 rodzaje energii: energie polaryzacji, przyciągania i odpychania. Wiązania wodorowe z jednej strony więc przyciągają do siebie sąsiednie cząsteczki wody, gdy są one od siebie zbyt daleko, z drugiej zaś strony odpychają je od siebie – gdy są zbyt blisko.
Pamiętając o obu rodzajach energii potencjalnej drzemiącej w roztworze cząsteczek wody – spróbujmy wyobrazić sobie ‘charakter’ wody – wyczujmy jej fizyko-chemiczną ‘osobowość’.
Zarówno energia dipol-dipol jak i energia mostków wodorowych to siły, które sprawiają że pomiędzy cząsteczkami wody NON-STOP zachodzą JEDNOCZEŚNIE relacje wzajemnego ODPYCHANIA i PRZYCIĄGANIA. Woda jest więc jednocześnie gęsta – dzięki siłom przyciągania, a jednocześnie płynna i nie-lepka – dzięki siłom odpychania. Siły te działają równomiernie we wszystkich możliwych kierunkach, a ich efektem końcowym jest określona… spójność wody. Jest to – po prostu – równomierne rozmieszczenie cząsteczek wody – w takich od siebie odległościach, przy których wszystkie siły międzycząsteczkowe się znoszą, a więc są ze sobą w swoistej równowadze.
W przypadku, gdy mamy do czynienia z czystą wodą, a więc taką, w której nic nie jest rozpuszczone – potencjał chemiczny wody jest największy, a jej spójność (rozmieszczenie cząsteczek) jest idealna. Takie wzorcowe, idealne rozmieszczenie cząsteczek wody nazywamy własnym stężeniem wody. Wynosi ono 55,6 mola/litr.
Co to znaczy?
Po prostu – jeśli pomiędzy cząsteczkami wody nie znajdują się żadne inne cząstki, to w objętości 1 lita znajdzie się dokładnie 55,6 moli* cząsteczek wody.
*) I tu przychodzi nam się zmierzyć z pojęciem MOLA – terminem niezbyt lubianym i – zazwyczaj – źle objaśnianym przez nauczycieli. Naprawmy to:
Co to jest tuzin? To, po prostu, 12 sztuk (czegokolwiek).
Co to jest mendel? To 15 sztuk.
Co to jest kopa? To 60 sztuk (czyli 4 mendle albo 5 tuzinów).
Co to jest gros? To 144 sztuki (tuzin tuzinów).
A co to jest mol? To 602214076000000000000000 sztuk (czegokolwiek).
Liczbę tę zapisujemy zwykle jako 6,02214076 × 1023 (Mnożenie przez 1023 oznacza tylko tyle, że przecinek powinien być przesunięty o 23 miejsca w prawo.)
Tak (!) MOL to – podobnie jak tuzin, mendel, kopa, milion i bilion – zwykła jednostka liczebności. Stosujemy ją do liczenia cząstek materii, a więc atomów, cząsteczek, jonów, elektronów i innych ‘super-mikro-małych’ rzeczy. Robimy to aby ułatwić sobie życie, gdyż odczytywanie liczb tego rzędu w sposób tradycyjny jest męczące i trudne. Potrafiłbyś to zrobić? Większość ludzi, w tym ja, miewa z tym kłopoty. Nawet pamiętając kolejność liczebników głównych – bilion, biliard, trylion, tryliard, kwadrylion, kwadryliard – i tak w końcu pogubiłbym się w zerach.
Dlaczego mol to akurat tyle cząstek? Bo tak i już. Liczba 6,02214076 × 1023 to tzw. liczba Avogadra, którą przyjęliśmy arbitralnie. (Podobnie jest z arbitralnością innych jednostek umownych: tuzin to 12 – bo tak i już.)
Najwyższy potencjał chemiczny ma woda czysta, a jej cząsteczki samorzutnie rozmieszczają się w takich od siebie odległościach, że w objętości 1 litra będzie ich 55,6 moli.
Tak się jednak składa, że woda w przyrodzie prawie nigdy nie występuje w stanie czystym, gdyż praktycznie zawsze coś jest w niej rozpuszczone (najczęściej gazy i sole), a więc mamy do czynienia z wodą – jako ROZTWOREM.
* *
OSMOZA
CIŚNIENIE OSMOTYCZNE [TONICZNE]
HIPER- HIPO- i IZOTONIA
O roztworach zwykle myślimy tak, jak nam to ‘wbito’ do głowy – że składają się z rozpuszczalnika i substancji w nim rozpuszczonej. To wymusza w nas przekonanie, że tylko substancja może rozpuszczać się w rozpuszczalniku, a rozpuszczalnik w tej substancji – już nie.
Proszę, abyś od tej chwili – choćby na krótki czas – przestała/przestał myśleć szablonowo. Czytając poniższe akapity myśl o roztworze jako o MIESZANINIE dwóch równorzędnych substancji w stanie ciekłym, gdyż 'rozpuszczanie’ to nic innego jak mieszanie się cząsteczek: Cząsteczki substancji pierwszej wnikają pomiędzy cząsteczki substancji drugiej, a cząsteczki tej drugiej – pomiędzy cząsteczki pierwszej. W tym sensie obie z substancji wzajemnie się w sobie rozpuszczają, gdyż jednocześnie A) rozcieńczają (tę drugą substancję) i B) same są (przez nią) rozcieńczane.
Jeśli pomyślisz o roztworze w ten sposób – z łatwością zrozumiesz przyczynę przemieszczania się wody pomiędzy przestrzeniami ciała.
Co się stanie, jeśli do czystej wody dodamy jakiejś innej substancji?
Cząsteczki tej substancji znajdą się pomiędzy cząsteczkami wody. Oznacza to, że odległości pomiędzy niektórymi cząsteczkami wody ulegną zwiększeniu. Spójność wody, czyli rozmieszczenie jej cząsteczek – nie będzie już taka jak poprzednio, gdyż cząsteczki innej substancji ‘ROZCIEŃCZYŁY’ wodę.
Idealnym samorzutnym rozmieszczeniem cząsteczek wody jest to, w którym jej stężenie wynosi 55,6 moli/litr. Mówimy, że wtedy woda ma największy potencjał chemiczny, czyli wtedy ‘woda najbardziej jest sobą’. Każda zmiana w rozmieszczeniu cząsteczek powoduje, że woda usiłuje przywrócić swój stan idealny. Rozcieńczenie wody sprawia, że pomiędzy jej cząsteczkami zaczynają przeważać siły wzajemnego przyciągania – tym silniejsze, im więcej obcej substancji znajduje się pomiędzy nimi.
W każdym roztworze wodnym powstaje więc pewna wewnętrzna siła – wewnętrzny nacisk cząsteczek wody, usiłujących zbliżyć się do siebie i przywrócić swój stan równowagi. Nacisk ten nazywamy ciśnieniem osmotycznym (tonicznym) wody.
Czas na doświadczenie z syropem:
Wyobraź sobie naczynie przedzielone na pół, zawierające przestrzeń A i przestrzeń B. Przegroda oddzielająca przestrzenie zbudowana jest z błony PÓŁPRZEPUSZCZALNEJ, czyli przepuszczalnej tylko dla wody.
*) Dlaczego ‘półprzepuszczalna’?
Błony biologiczne znajdujące się w organizmie to właśnie błony półprzepuszczalne. Sensem ich istnienia jest właśnie to, że stanowią barierę dla określonych rodzajów cząsteczek i jonów – nie stanowiąc przy tym bariery dla wody. Dzięki takiej budowie błon nasz organizm zachowuje kontrolę nad zawartością poszczególnych swoich przestrzeni – zarówno tych wewnątrzkomórkowych jak i tkankowych.
Jeśli obie przestrzenie zawierają czystą wodę, jej cząsteczki mogą bez przeszkód przepływać przez błonę, więc poziomy cieczy w obu przestrzeniach – wyrównają się.
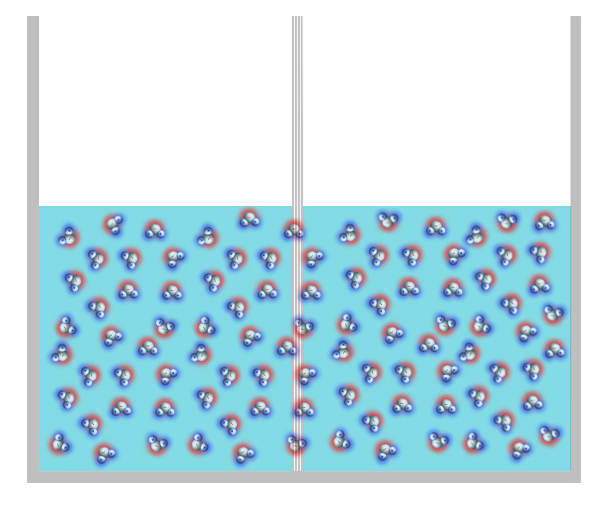
Jeśli jednak do przestrzeni A wlejemy czystą wodę, a do przestrzeni B – taką samą ilość wodnego roztworu cukru – zaczną dziać się przedziwne rzeczy.

W przestrzeni 'A’ (czysta woda) znajduje się więcej cząsteczek wody niż w przestrzeni 'B’ (roztwór cukru).
Zaobserwujemy, mianowicie, że – z biegiem czasu – poziom płynu w przestrzeni A zaczyna się obniżać, a w przestrzeni B – rosnąć. Oznacza to, że cząsteczki wody – mogące bez przeszkód przenikać pomiędzy przestrzeniami – poruszają się w kierunku roztworu cukru, podnosząc poziom płynu w przestrzeni B. Po jakimś czasie poziomy płynów przestają się zmieniać, co oznacza, że ustalona została nowa równowaga.

Skoro następuje ruch cząsteczek wody, to oznacza, że istnieje siła, która powoduje ten ruch. Siła ta nie pochodzi z zewnątrz, a więc tkwi w samej wodzie – jest wewnętrznym ciśnieniem roztworu wody – właśnie ciśnieniem tonicznym (osmotycznym).
Dlaczego tak się dzieje? I co się w ogóle dzieje?
Przegroda pomiędzy przestrzeniami nie jest przepuszczalna dla cząsteczek cukru, więc muszą pozostać tam, gdzie są. Jednakże dla wody przegroda stanowi jedynie przeszkodę tymczasową, gdyż ‘przeciskanie się’ cząsteczek wody przez błonę półprzepuszczalną musi trochę potrwać. Można więc powiedzieć, że dla wody nie istnieją przestrzenie A i B, tylko jedna wspólna przestrzeń AB. Z jednej strony tej przestrzeni cząsteczki rozmieszczone są idealnie, jednak z drugiej – są rozcieńczone, a więc przyciągają do siebie* inne cząsteczki wody.
*) Jak widać, ‘z punktu widzenia czystej wody’ – ciśnienie toniczne każdego roztworu jest podciśnieniem, które ‘wsysa’ cząsteczki wody poprzez błonę półprzepuszczalną.
Przemieszczanie się cząsteczek wody potrwa tak długo, aż ich rozmieszczenie w całej przestrzeni AB stanie się równomierne, a więc gdy powstanie nowy stan równowagi pomiędzy wszystkich siłami międzycząsteczkowymi wszystkich cząsteczek wody w przestrzeni AB. Wysokość słupa cieczy 'h’ (oznaczone na rysunku) jest miarą wielkości ciśnienia tonicznego.
A teraz – pozornie – skomplikujmy nieco sprawę:
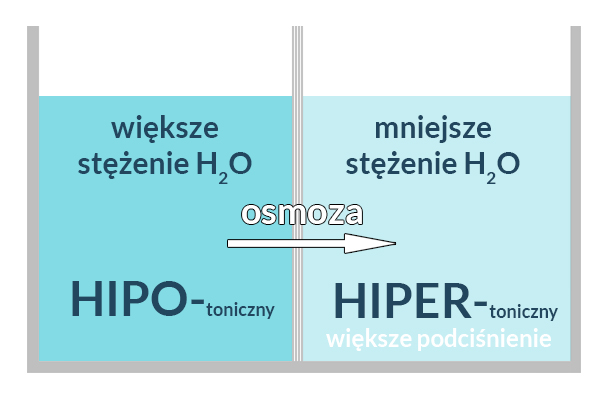
Wyobraź sobie, że do przestrzeni A wlewamy jeden roztwór cukru, a do przestrzeni B – inny roztwór cukru, o innym jego stężeniu. Co się stanie? Coś analogicznego: W przestrzeni A – wyjściowo – mamy roztwór, w którym cząsteczki wody rozmieszczone są tak, iż przyciągają się z określoną siłą, a więc posiadają określone ciśnienie toniczne; nazwijmy je ciśnieniem ‘A’. W przestrzeni B cząsteczki rozmieszczone są inaczej, więc przyciągają się z inną siłą (ciśnienie B).
Po obu stronach błony półprzepuszczalnej mamy więc roztwory o dwóch różnych ciśnieniach tonicznych. Jedno z tych ciśnień jest wyższe, a drugie niższe. Ta wzajemna relacja dwóch różnych ciśnień tonicznych – to relacja HIPER-HIPO (nadmiar-niedobór): roztwór o wyższym ciśnieniu tonicznym nazywany hipertonicznym, a ten o niższym ciśnieniu tonicznym – hipotonicznym.
Ruch cząsteczek wody poprzez błonę będzie trwał tak długo, aż rozłożą się one równomiernie w całej przestrzeni AB, a więc po obu stronach błony ciśnienie toniczne zostanie wyrównane.
Od tej chwili po obu stronach błony półprzepuszczalnej znajdują się roztwory o jednakowych ciśnieniach tonicznych. Nazywamy je izotonicznymi (IZO- = równy).
Dla dwóch roztworów są więc tylko dwie możliwe relacje toniczne: izo-izo lub hiper-hipo.
I o tym właśnie mówi pierwsze z praw homeostazy – prawo IZOTONII*:
ciśnienie toniczne (osmotyczne) płynów znajdujących się po obu stronach błony półprzepuszczalnej – jest jednakowe.
*) Niektórzy nazywają to prawo – prawem IZOOSMOLALNOŚCI.
Ruch cząsteczek wody przez błonę półprzepuszczalną – wywołany różnicą ciśnień osmotycznych panujących po obu stronach błony – nazywamy OSMOZĄ*.
*) Tu chcę cię uczulić na jedną rzecz. Tłumaczę ci zjawisko osmozy tak, jak – moim zdaniem – powinno być ono tłumaczone, a nie tak jak tłumaczy je wielu nauczycieli. Możesz więc zderzyć się z innym, niezbyt logicznym podejściem do tematu. Np. zjawisko OSMOZY najczęściej opisywane jest jako: „przenikanie cząsteczek rozpuszczalnika (wody) przez błony półprzepuszczalne z roztworu o stężeniu niższym do roztworu o stężeniu wyższym”.
Sądzę, że definicja ta jest nieprecyzyjna i więcej zaciemnia niż rozjaśnia. Mówimy tu o przenikającej przez błonę wodzie, ale jednocześnie przemilczamy różnicę jej stężeń po obu stronach błony – odwołując się jedynie do różnicy stężeń czegoś, co przez błonę nie przenika (bo nie może).
Jaki to ma sens? Po co wszystko komplikować?
Przecież woda przenika przez błonę zgodnie z jej własnym gradientem stężeń, czyli z roztworu o wyższym stężeniu wody do roztworu o jej stężeniu niższym.
Owszem, roztwór o wyższym stężeniu wody jest hipotoniczny w relacji do tego, który ma mniejsze stężenie wody, czyli posiada w sobie więcej cząstek 'obcych’ (a więc ma większe [pod]ciśnienie toniczne). W tym sensie woda, istotnie, przenika przez błonę od roztworu hipotonicznego – w kierunku hipertonicznego – aby zmniejszyć jego [pod]ciśnienie.
No to skomplikujmy sprawę jeszcze bardziej:
Jak wspomniałem, woda w przyrodzie prawie nigdy nie występuje w stanie czystym, więc praktycznie zawsze jest ona roztworem. Mało tego, w zasadzie prawie nigdy się nie zdarza, aby w wodzie rozpuszczony był tylko jeden składnik; zawsze jest ich tam całe mnóstwo.
Woda naszego organizmu nie jest tu wyjątkiem. Po obu stronach dowolnej z błon biologicznych naszego ciała – zawsze są dwa roztwory wodne zawierające wiele różnych substancji w nich rozpuszczonych. Jakie ciśnienie toniczne będzie miał każdy z takich roztworów wieloskładnikowych?
Wyobraź sobie, że w swoim laboratorium masz na półkach wszystkie możliwe substancje, jakie tylko rozpuszczają się w wodzie. Chcesz z nich stworzyć super-roztwór, przypominający składem jeden z płynów ustrojowych np. osocze ludzkiej krwi. Bierzesz więc 1 kg destylowanej wody i dodajesz po kolei wszystkie potrzebne składowe w odpowiednich proporcjach. Oczywiście – ciśnienie toniczne zależy od tego ile mmol * cząstek (jonów / atomów / cząsteczek) danej substancji przypada na określoną ilość wody.
*) mmol [milimol] = 1/1000 mola
Najpierw dodajesz elektrolity, rozpoczynając od sodu (Na+). Po dodaniu 143 mmol sodu do 1 kg wody – ciśnienie toniczne można zapisać właśnie taką proporcją: 143 mmol/kg H20. Jeśli teraz do tego roztworu dodasz 4 mmol potasu (K+), to w roztworze będziesz miał już 147 mmoli cząstek – przypadających na 1 kg wody.
Bez względu na to co to za cząstka, dodanie jej do określonej ilości wody – zwiększa globalną ilość ‘obcych’ cząstek znajdujących się pomiędzy cząsteczkami wody, a więc coraz bardziej rozcieńcza wodę, czyli zmienia jej ciśnienie toniczne. Dodając pozostałe elektrolity (2,7 mmol Ca2+; 0,8 mmol Mg2+; 102 mmol Cl–; 25,8 mmol HCO3–; 0,5 mmol HPO42-; 0,8 mmol białczanów; 1 mmol innych anionów) oraz glukozę (4,8 mmol) i mocznik (7,7 mmol) – będziemy mieli aż 293,1 mmol cząstek przypadających na 1 kg wody.
Każda z tych substancji ma swój cząstkowy udział w rozcieńczaniu wody, czyli w wytworzeniu globalnego ciśnienia tonicznego. Można więc powiedzieć, że – zależnie od ilości swoich cząstek w roztworze – każda z substancji wywiera cząstkowe ciśnienie toniczne.
Cząstkowe (parcjalne) ciśnienia toniczne osocza:
Na+ —————————- 143,0 mmol/kg H20
K+ ——————————– 4,0 mmol/kg H20
Ca2+ —————————— 2,7 mmol/kg H20
Mg2+ —————————– 0,8 mmol/kg H20
Cl– —————————– 102,0 mmol/kg H20
HCO3– ————————– 25,8 mmol/kg H20
HPO42- ————————– 0,5 mmol/kg H20
białczany ———————— 0,8 mmol/kg H20
inne aniony ——————— 1,0 mmol/kg H20
glukoza ————————- 4,8 mmol/kg H20
mocznik ———————— 7,7 mmol/kg H20
__________________________
razem: 293,1 mmol/kg H20
Przy okazji: Ciśnienie toniczne osocza osoby zdrowej mierzone osmometrem wynosi 295,2 mmol/kg H20
Podsumowując:
Ciśnienie toniczne dowolnego roztworu wieloskładnikowego – zależy od SUMY CZĄSTEK wszystkich substancji rozpuszczonych w wodzie. Dlaczego? Gdyż wszystkie te cząstki znajdują się pomiędzy cząsteczkami wody. Im jest ich więcej, tym bardziej zwiększają odległości pomiędzy cząsteczkami wody; im większe te odległości, tym większe siły przyciągania międzycząsteczkowego, czyli – tym większe [pod]ciśnienie toniczne roztworu.
Z pewnego punktu widzenia można więc powiedzieć, że ciśnienie toniczne roztworu wodnego nie zależy od tego CO jest rozpuszczone w wodzie, ale ILE tego jest rozpuszczone, a tak naprawdę – ile w tym roztworze jest wody. Chodzi tylko o wodę! Napiszę to explicite:
Ciśnienie toniczne zależy od ILOŚCI WODY w roztworze
Na zakończenie:
Czy różne rodzaje substancji mieszają się z cząsteczkami wody na różne sposoby, w różny sposób oddziałując na toniczność roztworu?
Owszem, nie wszystko po prostu ‘sobie pływa’ pomiędzy cząsteczkami wody. Pewna – większa lub mniejsza – część wielu substancji rozpuszczalnych w wodzie dysocjuje, tworząc przy tym jony dodatnie i ujemne, przez co zwiększa się ilość cząstek w roztworze. Inne substancje, np. wielocząsteczkowe polianiony białek lub kwasów nukleinowych – tworzą siły elektrostatyczne ‘wiążące’ spolaryzowane cząsteczki wody wokół siebie. Taka związana woda jest ‘osmotycznie nieczynna’ – więc zachowuje się tak, jakby znikła z roztworu. Zagadnienie to jest piekielnie ciekawe, jednak wykracza poza zakres niniejszego opracowania.
UWAGA:
Ciśnienie toniczne (osmotyczne) często nazywane jest ‘osmolalnością’ (albo ‘molalnością’) roztworu. Jest to ilość moli substancji zawarta w 1 kg rozpuszczalnika.
Pojęcia molalność /osmolalność należy rozróżnić z pojęciami molarność / osmolarność, które odwołują się do ilości moli substancji zawartych w 1 litrze roztworu.
* *

