Prawo IZOJONII
jest trzecią z elementarnych zasad kierujących homeostazą organizmu. Dwie pozostałe zasady (prawo izotonii i prawo elektroobojętności) omówiłem w poprzednich artykułach.
Generalnie prawo izojonii mówi, że ustrój dąży do utrzymania stałego stężenia jonów, w szczególności jonów H+. Jako że powołujemy się na to prawo – przede wszystkim – w odniesieniu do jonów wodorowych, regułę tę powinniśmy raczej nazywać prawem izohydrii, a brzmi ono tak:
Prawo Izohydrii
Organizm dąży do utrzymywania stężenia jonów wodorowych
w płynie pozakomórkowym w zakresie:
pH 7,35 – 7,45
Skrót pH oznacza ‘siłę jonów wodorowych’. W skrócie tym H to oczywiście symbol wodoru, natomiast symbol p jest pierwszą literą słowa oznaczającego siłę/moc/potęgę w co najmniej trzech językach: power (j. ang.), puissant (j. franc.), potennz (j. niem.).
Zwyczajowo, to utrzymywanie siły jonów wodorowych na określonym poziomie nazywamy równowagą kwasowo-zasadową. Aby zrozumieć czym tak naprawdę jest i jak działa ta równowaga wcale nie musimy wiedzieć, że pH to ujemny logarytm ze stężenia jonów wodorowych. Wystarczy, że zatrzymamy się na słowie ‘siła’ i przeanalizujemy następujące rozumowanie:
Wyobraź sobie czystą wodę.
Każda jej cząsteczka składa się z jednego atomu tlenu i dwóch atomów wodoru: H2O.
W stanie naturalnym jednakże nie wszystkie cząsteczki wody wyglądają identycznie, gdyż na każdy 1000 cząsteczek wody aż 18 ulega dysocjacji na OH– (jon wodorotlenowy) i H+ (jon wodorowy). A więc już w czystej wodzie mamy pewną stałą ilość jonów wodorowych – pewną ich ‘siłę’. Tę właśnie silę jonów wodorowych, jaka występuje w czystej wodzie – uznajemy za OBOJĘTNĄ. Na skali pH przyjmuje ona wartość 7:
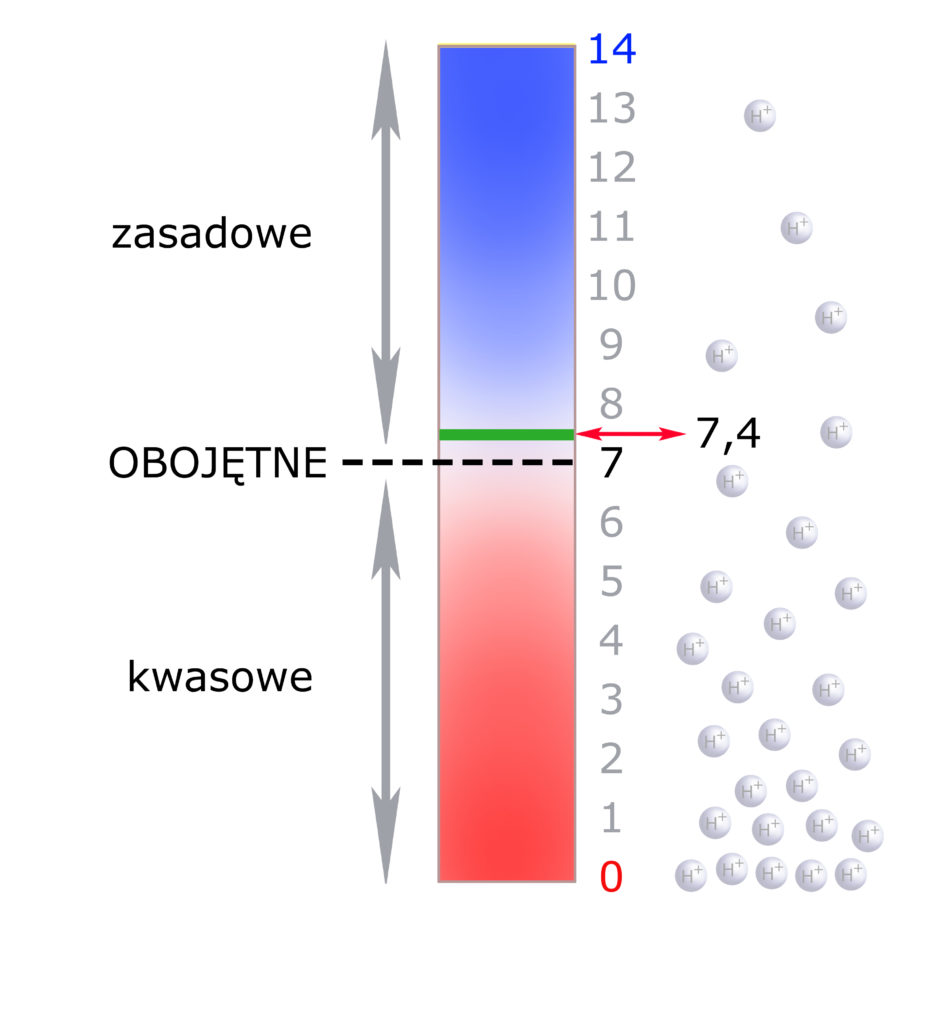
Skala pH obejmuje wartości od 0 do 14. Środek tej skali zajmuje pH 7, a więc pH obojętne, charakterystyczne dla czystej wody.
I teraz uwaga (!), bo wszystko jest trochę postawione na głowie:
- Jeśli w roztworze jest więcej jonów H+, a więc ich stężenie rośnie, to na skali pH przesuwamy się w dół (pH kwasowe – im bardziej kwasowe, tym bliżej 0);
- Jeśli jonów H+ jest mniej niż w wodzie – przesuwamy się w górę (pH zasadowe – im bardziej zasadowe, tym bliżej 14).
Na rysunku powyżej kolorem zielonym zaznaczono wartość pH ~7,4 będącą pożądaną siłą jonów wodorowych dla naszej przestrzeni pozakomórkowej. Jak widzisz – to pH jest lekko zasadowe.
Dlaczego dla organizmu tak ważne jest pH?
Posługujemy się pojęciami kwas, zasada, kwasowo-zasadowa…
Dla porządku – wyjaśnijmy te pojęcia: czym jest kwas, a czym zasada?
KWAS to substancja, która może ODDAWAĆ jony wodorowe H+.
ZASADA to substancja mogąca PRZYŁĄCZAĆ jony wodorowe H+.
Przyjrzyjmy się kilku takim substancjom:
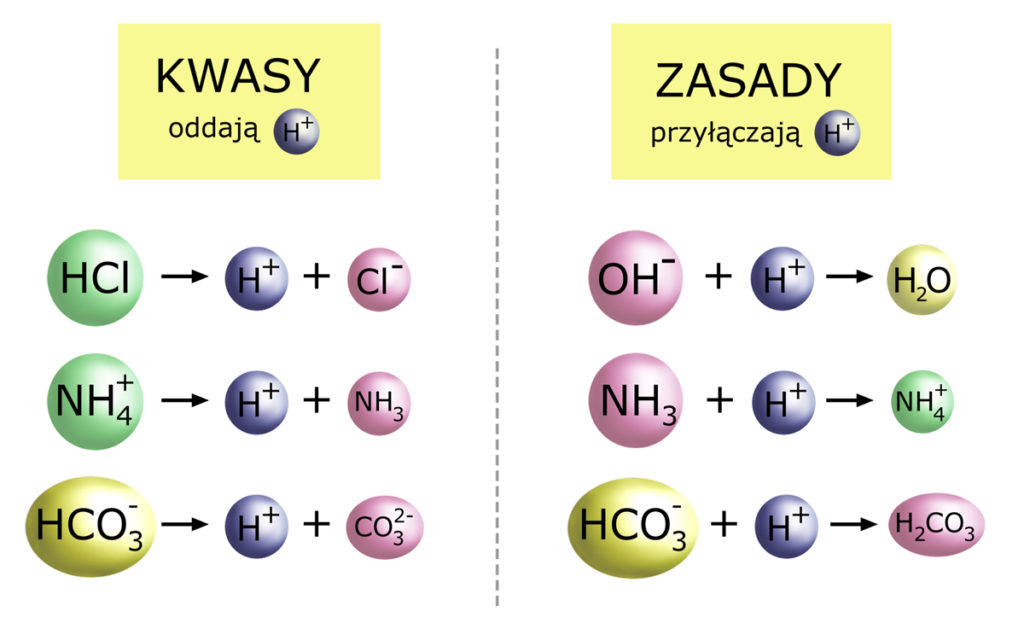
Zwróć uwagę na jon wodorowęglanowy HCO3–. Jest on jednocześnie kwasem (może oddawać H+) i zasadą (może przyłączać H+). Obie powyższe reakcje przedstawmy na jednym obrazku:
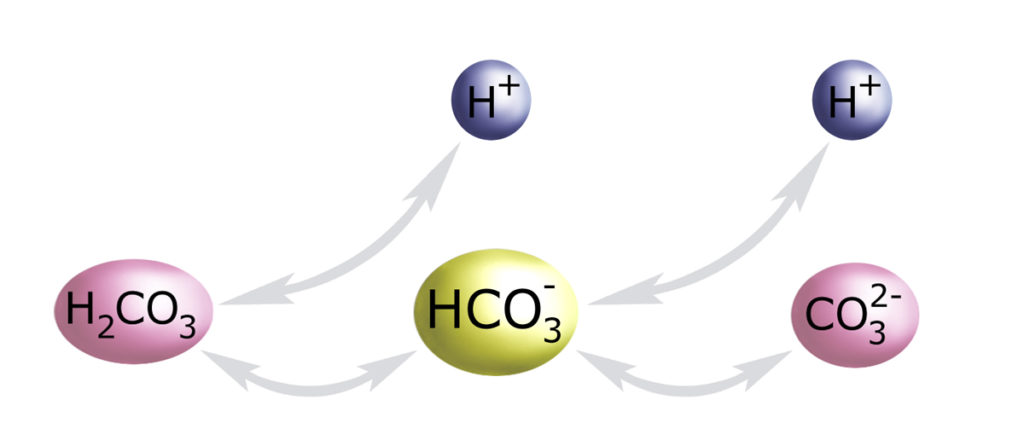
Kierunek tej rekcji zależy od środowiska: jeśli jest w nim zbyt wiele jonów H+, to je przyłączy (zmniejszając ich stężenie w środowisku), a jeśli jonów H+ jest zbyt mało, to je odda środowisku (zwiększając tam ich stężenie).
Ta właściwość HCO3– nazywa się amfoterycznością. Substancjami amfoterycznymi są też np. aminokwasy (i złożone z nich białka). Potrafią być jednocześnie i zasadą (posiadają zasadową grupę aminową -NH2) i kwasem (posiadają kwasową grupę karboksylową -COOH). Amfoteryczna jest również hemoglobina naszych krwinek czerwonych, która przechodząc w formę utlenowaną zachowuje się jak kwas, a oddawszy tlen – nabywa właściwości zasady.
Zjawisko amfoteryczności sprawia, że możliwe jest buforowanie pH.
Bufor Wodorowęglanowy
Aby zrozumieć istotę buforowania – przeanalizujmy zasadę, według jakiej dysocjuje kwas węglowy H2CO3.
Kwas węglowym NIE jest kwasem mocnym. Gdyby takim był, od razu zdysocjowałby w całości do CO32- i dwóch atomów wodoru. (To jest właśnie cecha kwasów mocnych: ich duży stopień dysocjacji). Kwas węglowy jednak jest kwasem SŁABYM, więc dysocjuje tylko w niewielkim stopniu do jonu wodorowęglanowego (HCO3–) i jednego atomu wodoru.
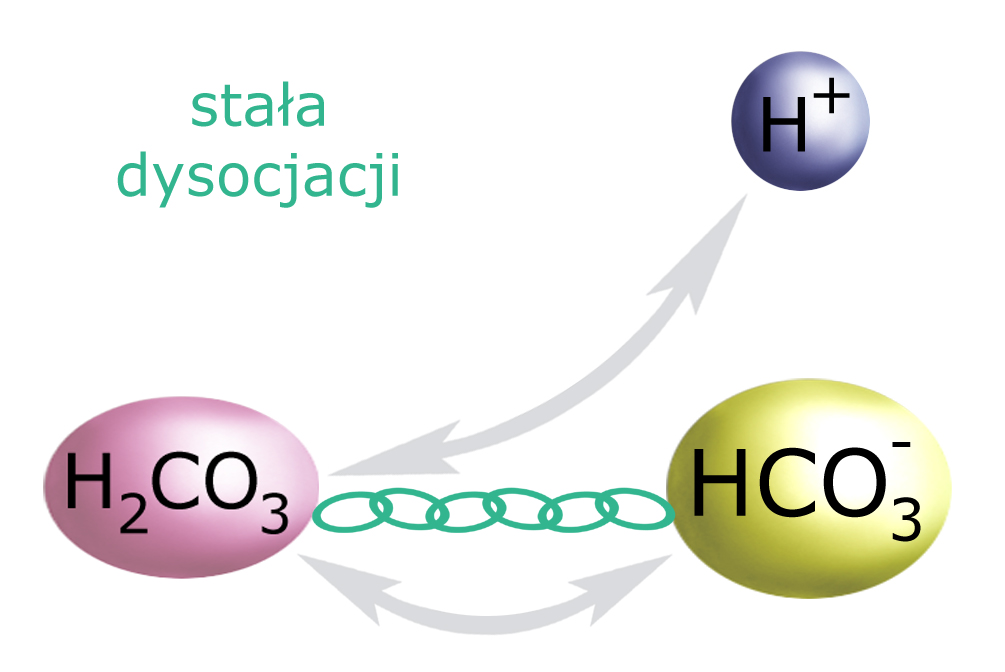
Stopień dysocjacji kwasu (a więc jego moc) określa wartość zwana stałą dysocjacji. (Na powyższym rysunku symbolizuje ją łańcuch) Jak sama nazwa wskazuje, dla każdej substancji jest to wartość stała. Oznacza to, że – przy dowolnym stężeniu danej substancji – w formie zdysocjowanej występuje (zawsze) jakiś stały procent jej cząstek.
Oznacza to, że ilość jonów H+ (pH) również zależy od tego ‘łańcucha’ stałej dysocjacji. Aby to zrozumieć rozpatrzmy dwie sytuacje: A) gdy do środowiska dostanie się mocny kwas, próbujący obniżyć pH, i B) gdy pojawi się tam mocna zasada, próbująca podnieść pH.
A) Kwas:
Mocny kwas sprawi, że w środowisku znajdzie się znaczny nadmiar jonów H+ . W tej sytuacji jon wodorowęglanowy (HCO3–) będzie wiązał H+, zamieniając się w kwas węglowy (H2CO3) – aż osiągnie równowagę na poziomie swojej stałej dysocjacji (stałego procenta cząstek zdysocjowanych). W efekcie pH zmieni się tylko nieznacznie. Proporcje H2CO3 i HCO3– pozostają stałe, ale skoro i tego i tego jest troszeczkę więcej – troszeczkę więcej będzie też jonów H+.
B) Zasada:
Mocna zasada w środowisku zwiększy ilość jonów OH– (wodorotlenowych). Jony te będą reagować z H2CO3 tworząc HCO3– i H2O. Część nowo powstałych jonów HCO3– przyłączy jony H+ zamieniając się w H2CO3 – aż osiągnie równowagę stałego procenta cząstek zdysocjowanych i nie (H2CO3 / HCO3–). W efekcie i teraz pH zmieni się tylko nieznacznie.
Tak więc roztwór słabego kwasu (H2CO3) i jego soli (HCO3–) potrafi ZBUFOROWAĆ zarówno mocny kwas jak i mocną zasadę. Jak widzisz, bufor ’łagodzi’ nagłe zmiany pH (potrafi wiązać zarówno jony H+ jak i jony OH–).
* *
I teraz pytanie zasadnicze: skąd bierze się ten kwas węglowy w naszym organizmie? Ha! I teraz dopiero będzie ciekawie, bo – w końcu – zaczniemy łączyć wszystkie kropki.
Aby żyć – musimy mieć energię.
Aby mieć energię – musimy ją wytworzyć.
Aby wytworzyć energię – musimy oddychać.
Ubocznym produktem oddychania tkankowego jest… DWUTLENEK WĘGLA (CO2)
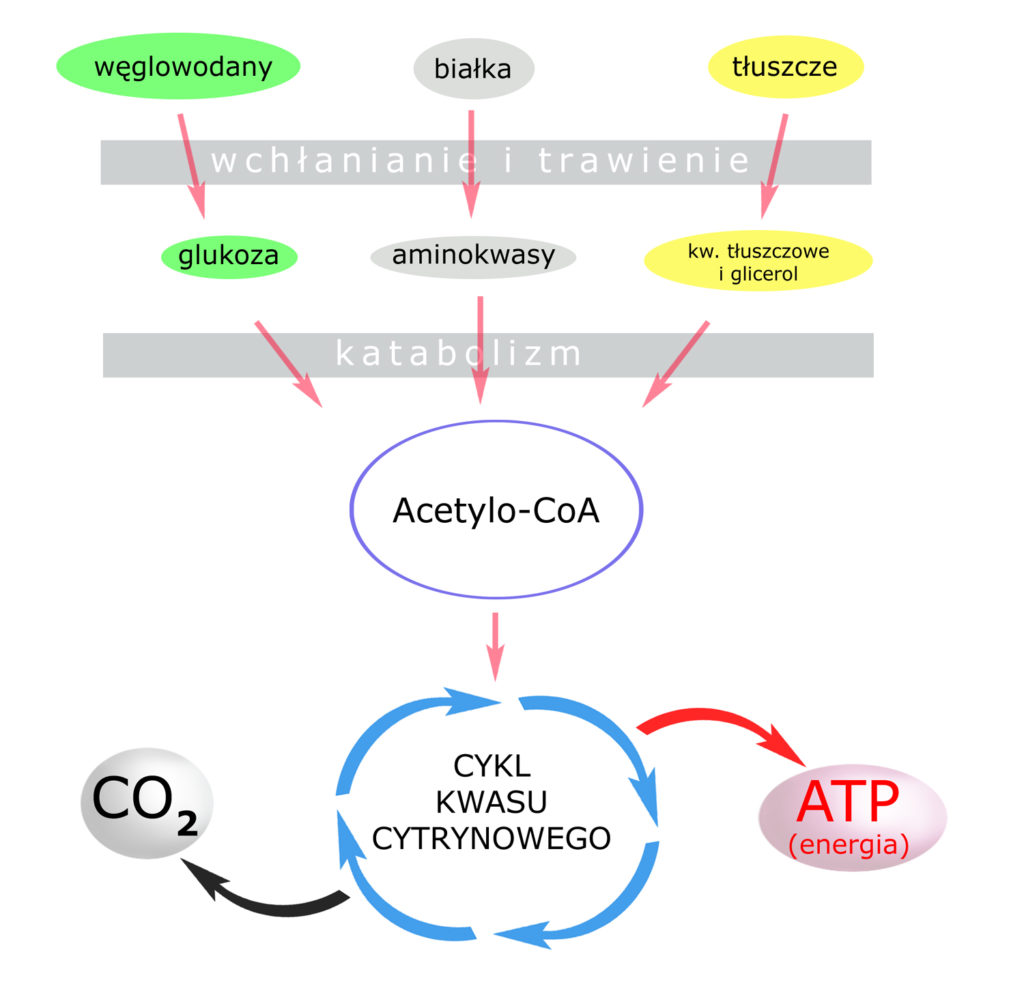
Bingo!
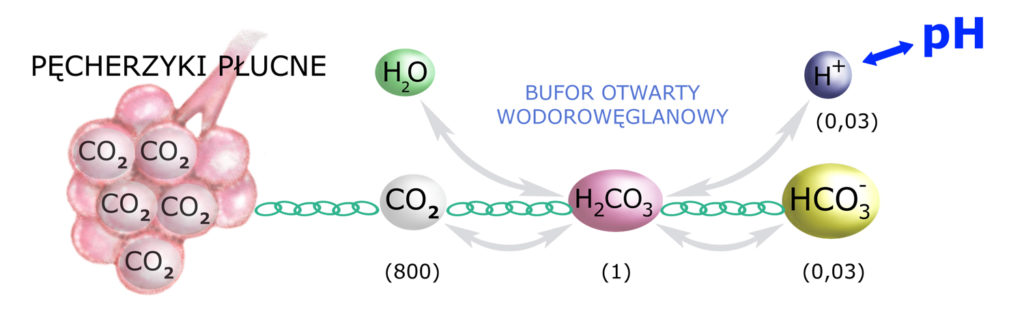
Końcowym produktem oddychania, produkowanym w każdej komórce naszego organizmu – jest CO2. Dwutlenek węgla jest rozpuszczony w płynach naszego organizmu, ale (!) nie w całości, gdyż jego 1/800 część ulega ‘uwodnieniu’ (połączeniu z wodą) – do H2CO3.
Uzupełnijmy zatem nasz schemat buforowania o ten element (i ogólne proporcje):
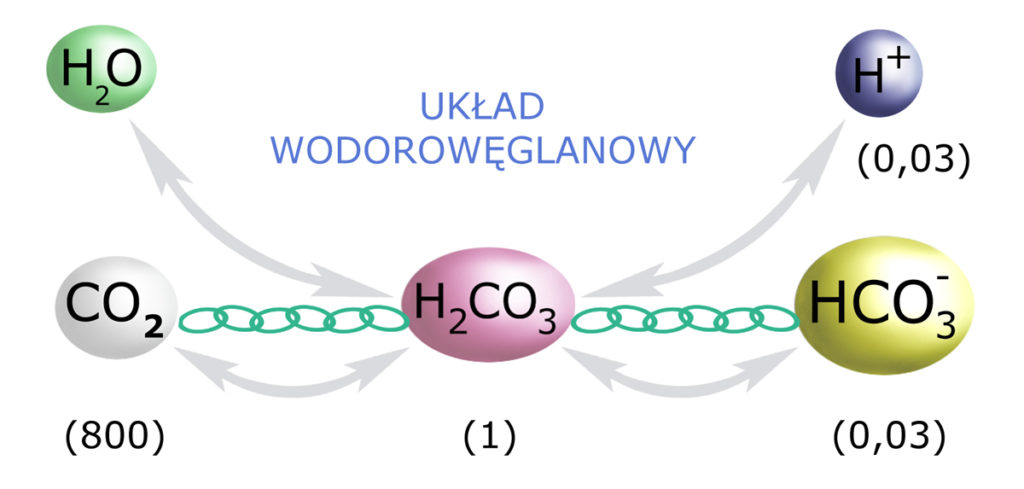
A więc istotnym elementem całej układanki jest CO2. On również powiązany jest łańcuchem zależności ze stężeniem (ilością) H2CO3 (proporcje 800:1): Im więcej dwutlenku węgla w naszej przestrzeni pozakomórkowej (a więc w osoczu krwi i płynie śródmiąższowym), tym więcej kwasu węglowego i tym więcej jonów wodorowych = tym mniejsze pH.
A więc nadmiar CO2 – zakwasza nasz organizm.
Cóż, należałoby wreszcie przyznać, że w całym tym zamieszaniu chodzi po prostu o ODDYCHANIE: Pobieramy tlen z płuc i doprowadzamy go do komórek, gdzie przy jego pomocy utleniamy substraty energetyczne, aby uzyskać energię. Produktem ubocznym tego procesu jest dwutlenek węgla, który przedostaje się do płynu pozakomórkowego i… zakwasza go (zamieniając się w kwas węglowy H2CO3). Musimy się więc pozbyć CO2. Drogą krwi transportujemy go do płuc i wydychamy (tworząc, przy okazji, nasz osobisty ślad węglowy w atmosferze, w ilości 450 litrów CO2 na dobę; swoją drogą – ciekawe, kiedy UE wpadnie na pomysł, by nas opodatkować za oddychanie).
A właśnie! Pozbywanie się CO2 to ostatni element układu buforującego – ten, którego brakowało. Bufor wodorowęglanowy jest bowiem buforem OTWARTYM, co znacznie zwiększa jego wydajność.
Zanim omówię działanie buforu otwartego trzeba wspomnieć, że bufor wodorowęglanowy – chociaż najbardziej znaczący, gdyż odpowiada za 53% pojemności buforowania – nie jest jedynym buforem naszej krwi. Prócz niego dużą rolę odgrywa też bufor hemoglobinowy (35%). Za pozostałe 12% buforowania odpowiadają bufory białczanowy, fosforanowy i bufory kwasów organicznych.
Działanie Buforu Otwartego
Bufory wodorowęglanowy (HCO3–) i hemoglobinowy (Hb) ściśle ze sobą współpracują, gdyż składniki buforu HCO3– z łatwością przenikają przez błonę krwinki czerwonej i pozostają w dynamicznej równowadze z zawartą w krwince hemoglobiną.
Wspomniałem wcześniej, że hemoglobina wykazuje właściwości amfoteryczne: czasem zachowuje się jak kwas, a czasem jak zasada. Dzieje się tak dlatego, że mechanizm wiązania i uwalniania tlenu przez hemoglobinę – ściśle wiążę się z jej zdolnością do oddawania i przyłączania jonów H+:
Wiążąc O2 – hemoglobina oddaje H+.
Uwalniając O2 – hemoglobina przyłącza H+.
Zdolność ta bardzo przydaje się naszemu tandemowi buforów HCO3– / Hb, gdyż przyłączanie i uwalnianie H+ zachodzi dokładnie wtedy gdy trzeba i tam gdzie trzeba.
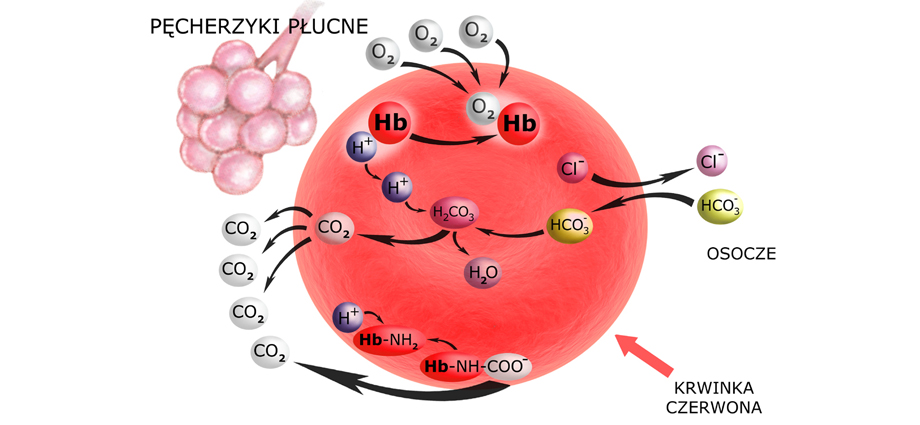
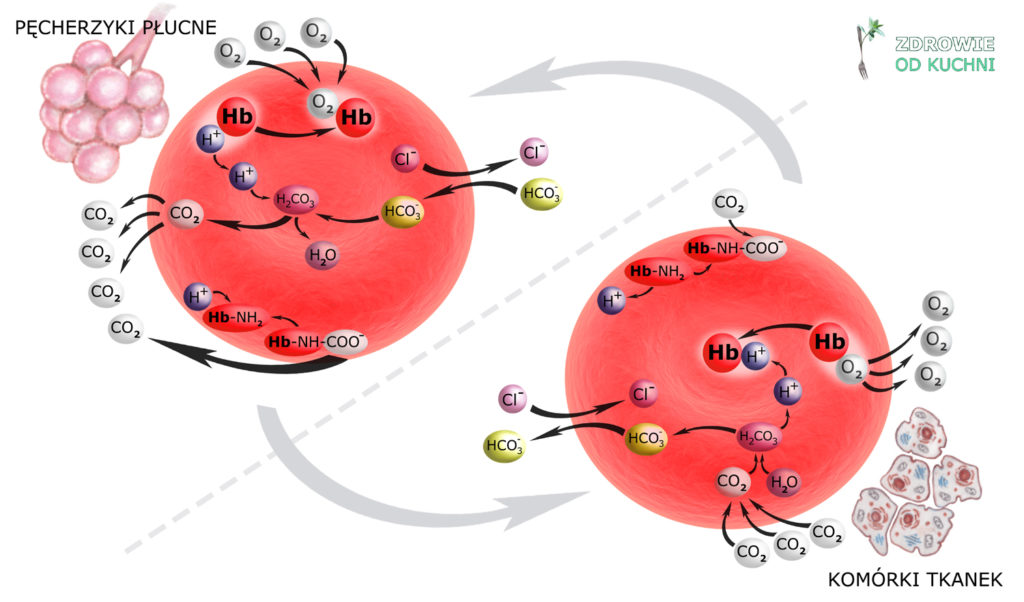
Przeanalizujmy – co się dzieje na poziomie tkanek:

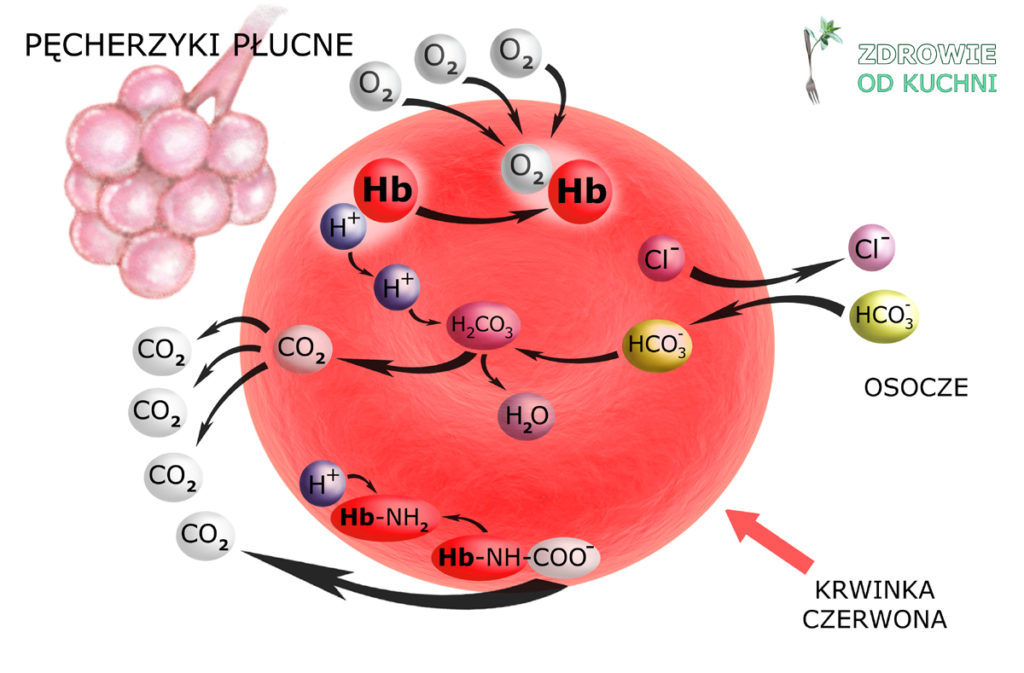
Docierająca do tkanek krew tętnicza niesie czerwone krwinki, w których hemoglobina jest utlenowana (oksyhemoglobina). Oddawszy tlen tkankom, hemoglobina zamienia się w mocną zasadę buforową, zdolną do przyłączania H+.
Powstały w komórkach tkanek CO2 dyfunduje do płynu śródmiąższowego, stąd do osocza krwi i do wnętrza krwinek czerwonych. Tu – przy udziale dehydratazy węglanowej – ulega uwodnieniu (hydratacji) do H2CO3, z którego powstaje HCO3– i H+.
Wolna już od tlenu hemoglobina wiąże jon H+ – buforując cały układ. Zauważ: ten związany z hemoglobiną H+ ‘znika’, a więc nie powiększa już ‘siły jonów wodorowych’, czyli nie obniża pH płynu pozakomórkowego. To niejako przesuwa równowagę układu, umożliwiając uwodnienie kolejnych cząsteczek CO2.
Te cząsteczki CO2, które nie zostały uwodnione – albo przyłączają się do grup aminowych hemoglobiny tworząc karbaminiany (Hb-NH-COO–) albo podróżują drogą osocza jako CO2 w nim rozpuszczony.
Na koniec – zwróć uwagę na to, co stało się z powstałym w krwince wodorowęglanem. Jego transport do płuc nie odbywa się we wnętrzu krwinki czerwonej. Zgodnie z gradientem stężeń przechodzi on do osocza. Aby jednak prawo elektroobojętności zostało zachowane, anion HCO3– wymienia się z anionem chlorkowym Cl– (którego w płynie pozakomórkowym jest pod dostatkiem).
* *
Gdy erytrocyty (krwinki czerwone) dotrą do płuc zachodzi, rzecz jasna, proces odwrotny, gdyż warunki panujące w naczyniach włosowatych pęcherzyków płucnych są odmienne od tych, które były przyczyną zmian opisanych powyżej.
Ciśnienie parcjalne tlenu jest w płucach dwa i pół razy wyższe niż w tkankach. Hemoglobina zmienia swój kształt i nabiera cech kwasu – uwalnia jon H+ i przyłącza tlen, stając się oksyhemoglobiną. Jednocześnie karbaminiany uwalniają CO2, gdyż nagły nadmiar jonów H+ w cytoplazmie krwinki transformuje też grupy aminowe hemoglobiny.
Do wnętrza krwinki znów zaczyna napływać wodorowęglan HCO3– z osocza (wymieniając się z jonem Cl–). Łączy się on z H+ tworząc H2CO3, a dehydrataza węglanowa tym razem ułatwia reakcję w stronę przeciwną, a więc powstanie CO2 i H2O.
W pęcherzykach płucnych panuje mniejsze niż we krwi stężenie dwutlenku węgla. Powstający w krwince CO2 dyfunduje do osocza a następnie do światła pęcherzyków płucnych.
Ujmijmy wszystko w całość:
I – na koniec – przyszła pora na wyjaśnienie istoty buforu otwartego.
Jest to taki bufor, w którym możliwa jest komunikacja pomiędzy fazą wodną i gazową.
CO2 – będący przecież składnikiem buforu wodorowęglanowego – jest gazem (!). W układzie otwartym, a więc w warunkach, jakie panują w płucach, CO2 rozpuszczony w naszym płynie pozakomórkowym może komunikować się (wymieniać) ze środowiskiem gazowym – powietrzem atmosferycznym.
Przypomnijmy sobie budowę układu wodorowęglanowego i wzbogaćmy go o ostatni element, a więc pęcherzyki płucne, które sprawiają, że bufor ma charakter otwarty:
Gaz rozpuszczony w fazie wodnej pozostaje w równowadze z tym w fazie gazowej, przy czym jego stężenie jest wprost proporcjonalne do ciśnienia gazu nad cieczą*.
*) Na marginesie: ta zależność wyjaśnia istotę choroby kesonowej: głęboko pod wodą panuje wysokie ciśnienie, czyli więcej CO2 rozpuszcza się w osoczu; jeśli nurek wynurza się zbyt szybko – w jego naczyniach krwionośnych wydzielają się pęcherzyki CO2.
A więc CO2 osocza, którego jest więcej niż w pęcherzykach – będzie usuwany do płuc i wydychany. Jego ilość więc zmniejszy się w osoczu. Ale (!) ten CO2 z osocza jest w stanie równowagi z H2CO3, a ten z kolei z HCO3– i H+ – którego ‘siła’ to przecież pH.
Tak więc oddychając – obniżamy pH krwi*.
*) Możemy nawet ‘przedobrzyć’ z tym naszym oddychaniem – co ma miejsce w atakach paniki: histerycy nadmiernie dyszą, co podnosi pH krwi do zasadowego. Dlatego wtedy doraźnym rozwiązaniem jest worek papierowy: oddychając do worka wdychamy to samo powietrze, które wydychamy, przeciwdziałając zasadowicy krwi.
Przy okazji: odwrotnie działały ‘pandemiczne’ maseczki – wprowadzając organizm w kwasicę.
Właśnie dlatego bufor otwarty ma kilkakrotnie większą pojemność od buforu zamkniętego. Gdybyśmy nie usuwali CO2 jego stężenie w osoczu rosłoby, przesuwając równowagę w prawo – do większych stężeń , a więc do kwasowego pH.
Podsumowując:
BUFOROWANIE to wiązanie lub uwalnianie jonów wodorowych – tak, by ich 'siła’ w przestrzeni pozakomórkowej pozostawała na odpowiednim poziomie (pH 7,35 – 7,45), zwanym równowagą kwasowo-zasadową.