W kilku poprzednich opracowaniach starałem się przybliżyć mechanizmy leżące u podstaw homeostazy, w szczególności trzy podstawowe zasady, którymi MUSI kierować się organizm. Dopiero teraz, gdy mamy już w pamięci te zasady (tj. prawa izotonii, izojonii i elektroobojętności) możemy przyjrzeć się poszczególnym ścieżkom metabolizmu.
W zrozumieniu istoty zmian zachodzących w naszym ciele bardzo pomocne jest wyobrażenie sobie naszego organizmu jako systemu składającego się z wielu ogniw połączonych ze sobą relacjami wzajemnych zależności. Trzy wspomniane prawa nie tylko wymuszają określoną strukturę panujących zależności, ale stanowią też narzędzia jakimi posługują się ogniwa zarządzające całym systemem.
Chodzi oczywiście o REGULACJE, a w zasadzie o autoregulacje, jakie zachodzą w naszym organizmie. Ośrodkowy układ nerwowy wykształcił szereg ogniw zarządzających, które kontrolują homeostazę i przeciwdziałają wszelkim jej zaburzeniom. Ogniwa te wpływają na określone ogniwa podrzędne – poprzez substancje (hormony), które docierają do nich drogą krwi, wywołując wymagany skutek (zmiana zachowania ogniwa podrzędnego). Dzięki temu – homeostaza zostaje przywrócona.
Pierwszym z układów, któremu się przyjrzymy – z racji tego, że ma niesłychanie ważne znaczenie dla wielu procesów biologicznych (a więc wpływa na wiele innych ogniw systemu) – będzie…
Metabolizm Wapniowy
Prawidłowe stężenie wapnia w osoczu wynosi ~2,5 mmol/l i waha się w bardzo wąskich granicach (norma: 2,12 – 2,62 mmol/l). Nie jest to przypadek. Nasz organizm dokłada wszelkich starań, aby stężenie to pozostawało na stałym poziomie, gdyż od tego zależy: przepuszczalność błon komórkowych miliardów komórek organizmu, jakość przewodzenia bodźców nerwowych (pobudliwość nerwów) i kurczliwość mięśni (w tym mięśnia sercowego), a także możliwość działania wielu enzymów (np. lipazy lub ATP-azy) i prawidłowe funkcjonowanie układu krzepnięcia krwi (aktywuje przemianę protrombiny w trombinę), itp. itd.
Jeśli czytujesz moje opracowania to wiesz, że nie lubię wyliczanek, bo najczęściej są pisane przez ciołków dla ciołków. Zdecydowałem się na to jedynie po to, aby podkreślić nieodzowność precyzyjnej kontroli poziomu wapnia we krwi. Jeśli od czegoś zależy tak wiele elementarnych relacji biochemicznych – musi być trzymane w ryzach i regulowane.
Wapń występuje we krwi w trzech postaciach. Najważniejszą z nich – tą, która jest biologicznie aktywna, a więc która bezpośrednio wpływa na regulację – jest postać wolna, czyli wapń występujący jako jony Ca2+ (zjonizowany). W formie tej występuje nieco mniej niż połowa wapnia krwi (~48%). Drugą, równą ilościowo postacią (~46%) jest wapń związany z białkami krwi (głównie albuminami), które są ogromnymi cząsteczkami – zbyt dużymi, aby przenikać przez ściany naczyń włosowatych. Trzecia postać (~5-6%) to wapń kompleksowy, a więc połączony w kompleksy z małocząsteczkowymi anionami (cytryniany, fosforany, węglany). W przeciwieństwie do wapnia związanego z białkami, wapń zjonizowany i kompleksowy przenika przez ściany naczyń włosowatych do płynu śródmiąższowego tkanek.
Blisko 99% wapnia organizmu związane jest w tkance kostnej, 1% przypada na przestrzeń wewnątrzkomórkową, a jedynie 0,1% – na osocze i płyn śródmiąższowy (przestrzeń zewnątrzkomórkową). Tak więc regulacja o której będziemy mówić dotyczy 0,1% puli całego wapnia organizmu.
* *
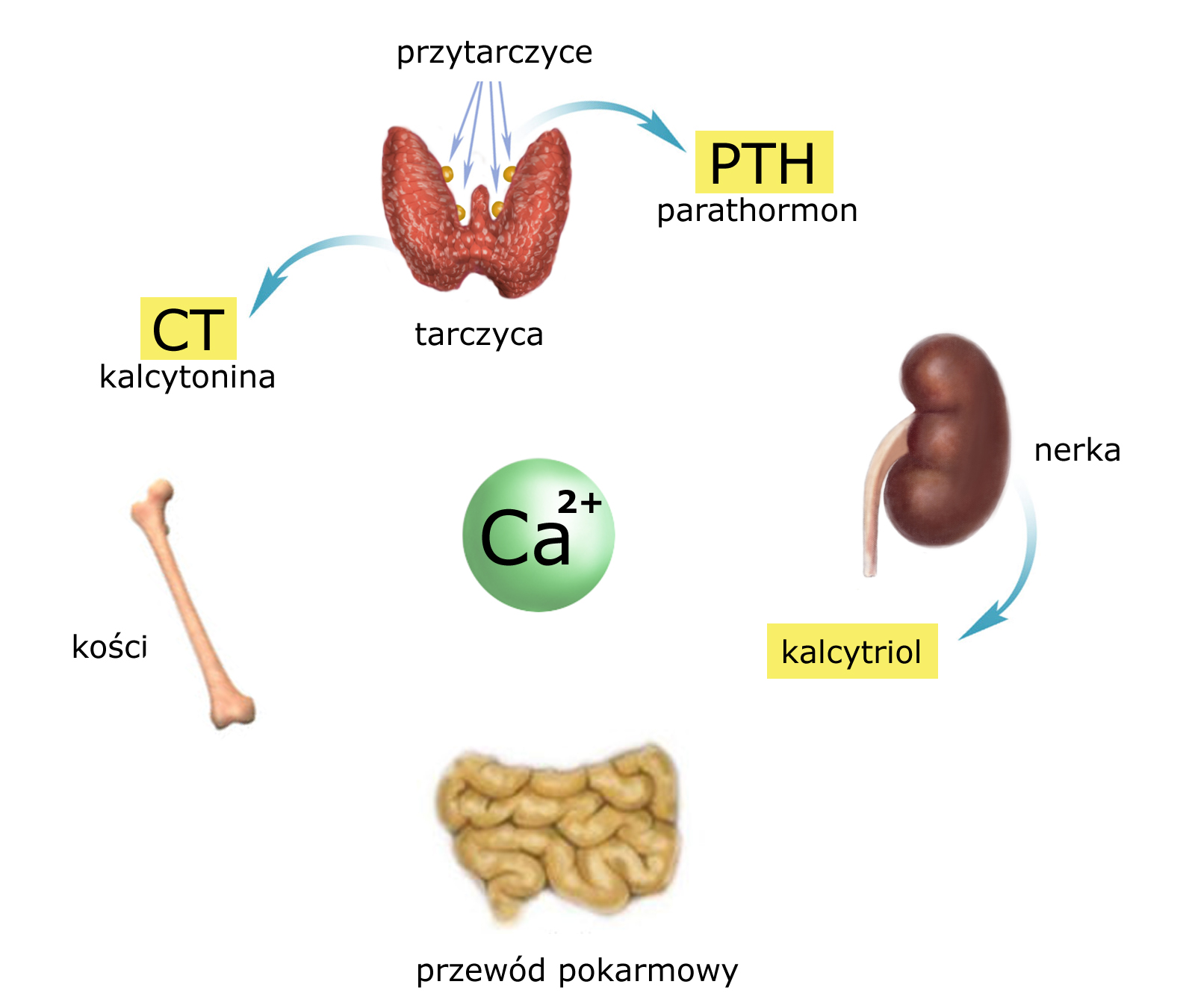
Na początek wyliczmy główne* ogniwa (oraz hormony), które biorą udział w regulacji homeostazy wapniowej:
OGNIWA:
– przewód pokarmowy (wchłanianie wapnia)
– kości (główny rezerwuar wapnia, buforujący jego stężenia w płynach ustrojowych)
– nerka (miejsce wydalania)
HORMONY:
– parathormon (PTH) produkowany przez gruczoły przytarczyczne
– kalcytriol (postać aktywna witaminy D) produkowany przez nerkę
– kalcytonina (CT) produkowana przez tarczycę
*) Na gospodarkę wapniową wpływają też inne hormony (glikokortykosteroidy, hormon wzrostu, estrogeny, insulina) jednak w niniejszym opracowaniu wpływy te zostaną pominięte.
Gospodarkę wapniową omówiłem pobieżnie w opracowaniu dotyczącym witaminy D, jednak – jako że bohaterem tamtego artykułu była sama witamina – pora przyjrzeć się metabolizmowi wapnia bez faworyzowania któregokolwiek z jego elementów.
Zacznijmy od przewodu pokarmowego.
Wchłanianie Wapnia
w Przewodzie Pokarmowym
Generalnie przyjmuje się, że wchłanianie wapnia jest zależnie od zapotrzebowania i oparte na mechanizmie sprzężenia zwrotnego. A więc – sielanka: ‘Mam za mało wapnia? To zjem i będę miał dużo’. Owszem, byłoby pięknie, gdybyśmy w tym miejscu mogli postawić kropkę, jednak nie możemy (!), gdyż zawarty w pożywieniu Ca2+ napotyka na kilka przeszkód.
Przeszkoda nr 1:
Czynnikiem bezpośrednio regulującym zdolność enterocytów jelita do wchłaniania Ca2+ jest jego STĘŻENIE WE KRWI. (Np. jeśli sole wapnia podamy dożylnie – jelito przestaje wchłaniać wapń.) Przeszkoda ta – jak się przekonasz – dość często krzyżuje nam plany żywieniowe.
Przeszkoda nr 2:
Wchłanianie Ca2+ w dużym stopniu zależy od jego biodostępności, a więc nie tylko od tego, w jakiej postaci występuje w jelitach, ale też – w jakim towarzystwie. Chodzi tu o jego formę chemiczną: dobrze wchłaniają się jedynie ROZPUSZCZALNE SOLE wapniowe. W chwili jednak, gdy w jelicie dojdzie do utworzenia nierozpuszczalnych soli Ca2+ (węglanowych, fosforanowych, fitowych) albo mydeł (z kwasami tłuszczowymi) – w takiej postaci wapń się nie wchłonie.
Oznacza to, że jelitowe towarzystwo np. zbyt dużej ilości tłuszczów i fosforu – zamieni Ca2+ w związki ‘niewchłanialne’ (mydła i fosforany wapnia). Często podkreśla się fakt, że dla wchłaniania wapnia niekorzystna jest obecność dużej ilości fosforu w racji pokarmowej (stosunek Ca/P), ale rzadko kto podkreśla zabójczą rolę nadmiaru tłuszczów. (Zdarzyło mi się to tylko raz w życiu: dr McDougall mówił o tym explicite na którejś ze swoich jutubowych pogadanek.)
Przyjmuje się, że najkorzystniejszą proporcją wapnia do fosforu (Ca/P) jest stosunek 1/1, przy czym jest to stosunek molowy (tyle samo cząsteczek wapnia, co cząsteczek fosforu). Jeśli zechcemy to wyrazić w proporcji wagowej, stosunek przyjmuje postać 1,3/1, a więc – wagowo – nieco więcej wapnia niż fosforu. W standardowej diecie klienteli marketów spożywczych – proporcje takie są nie do osiągnięcia. Dzieje się tak dlatego, gdyż:
A) Fosforu w ogóle jest dość dużo we wszystkich możliwych produktach spożywczych i w zasadzie nigdy nie stwierdza się ich niedoborów
B) W procesach technologicznych związki fosforu są bardzo często używane jako substancje dodatkowe – poprawiacze cech organoleptycznych (smaku, zapachu, konsystencji). Dotyczy to w szczególności produkcji wędlin, serów topionych, koncentratów w proszku (zup i deserów), płatków śniadaniowych i napojów.
Co prawda – do żywności zaczęto ostatnio dodawać również wapń, ale jaki jest tego sumaryczny efekt – trudno oszacować.
I tutaj znowu przychodzi nam pokłonić się produktom roślinnym. Otóż w strączkowcach i produktach zbożowych znaczna część fosforu występuje w postaci kiepsko rozpuszczalnych fitynianów, co utrudnia jego wchłanianie. Tak więc rośliny znów górują nad produktami zwierzęcymi – tym razem na polu proporcji Ca/P.
Przeszkoda nr 3:
Aby wapń w ogóle wchłaniał się w jelicie, wymagana jest OBECNOŚĆ KALCYTRIOLU, czyli aktywnej formy witaminy D (oraz obecność enzymu ATP-azy Ca2+-zależnej). W jednym z opracowań odnalazłem wzmiankę, że przy dużej zawartości w pożywieniu jakaś część wapnia wchłonie się i bez kalcytriolu – w następstwie biernej dyfuzji. Nie wiem jednak czy to prawda, gdyż pozostałe podręczniki o tym nie wspominają. Utrzymują wręcz, że zarówno wnikanie Ca2+ ze światła jelita do enterocytów, jak i przenikanie z enterocytów do przestrzeni pozakomórkowej – wymaga kalcytriolu, w celu syntezowania białka wiążącego i transportującego wapń.
Przeszkoda nr 4:
Jest nią tzw. OŚ JELITOWO-TARCZYCOWA (będzie o tym mowa pod koniec opracowania). Organizm czuwa, by skok stężenia wapnia (wchłoniętego podczas posiłku) nie był zbyt gwałtowny. Dlatego hormony żołądkowo-jelitowe (głównie gastryna) pobudzają wydzielanie kalcytoniny, która MA UTRUDNIAĆ zbyt entuzjastyczne wchłanianie wapnia przez organizm.
Tak więc – jak widzisz – proces przyswajania wapnia z pożywienia nie przypomina wrzucania wapna do beczki. Wchłoniemy wapń tylko wtedy, gdy 1) w pożywieniu będzie on występował w postaci swoich rozpuszczalnych soli, przy czym 2) na enterocyty będzie działał kalcytriol, oraz 3) w momencie wchłaniania – stężenie wapnia we krwi nie będzie zbyt wysokie i wreszcie 4) wapń nie będzie się wchłaniał zbyt szybko.
Wapń – generalnie – wchłania się… ‘niechętnie’.
Przedstawię to obrazowo: Jeśli zjem 30 cząsteczek Ca2+, to w moim jelicie dodatkowo pojawi się 15 cząsteczek wapnia pochodzących z moich własnych soków trawiennych. Z tych 45 cząsteczek wchłonę tylko 18, a cała reszta jedynie zwiedzi moje jelito. Odzyskam więc wapń moich soków trawiennych, ale dodatkowo wchłonę tylko 3 cząsteczki, a więc 1/10 tego, co włożyłem do ust. (Dokładnie tyle samo – 3 cząsteczki – wydalę z moczem.)
* *
Tkanka Kostna
/Rezerwuar Wapnia/
Jednym z rodzajów tkanki łącznej jest tzw. tkanka oporowa lub podporowa. Przyjmuje ona postać tkanki kostnej (albo chrzęstnej, ale chrzęstną dzisiaj pomijam).
Tkanka kostna składa się z macierzy pozakomórkowej (na którą składają się dwa komponenty organiczny i nieorganiczny) oraz trzech typów komórek: osteoblastów, osteocytów i osteoklastów.
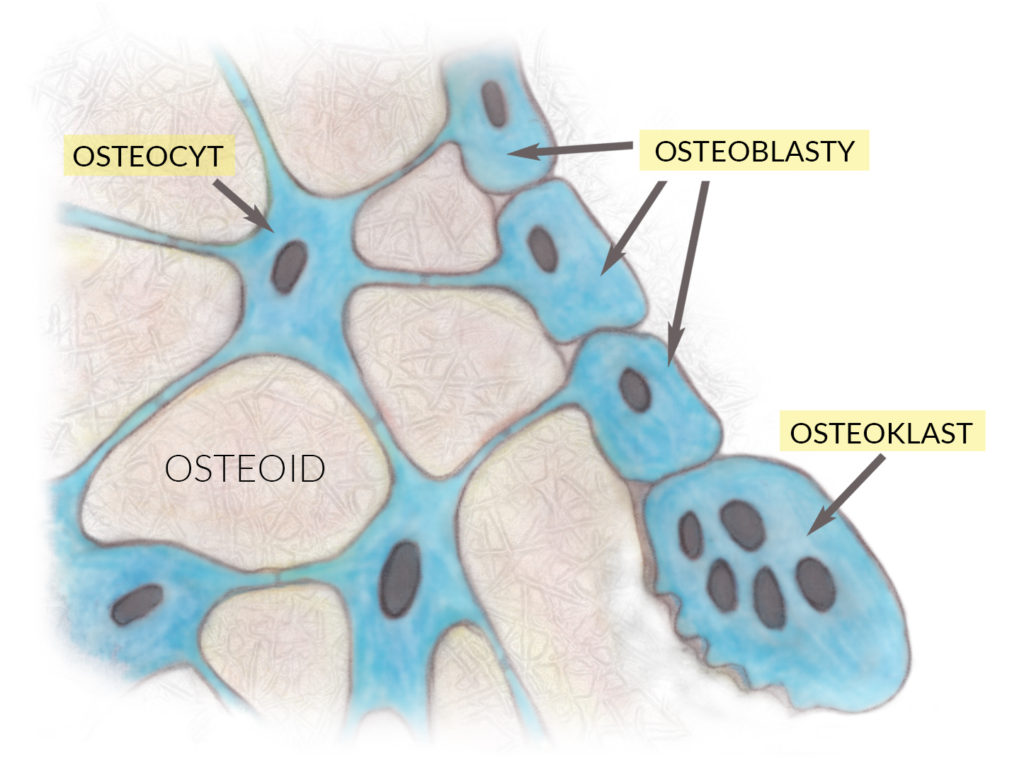
1. Osteoblasty (komórki kościotwórcze) produkują organiczną część macierzy (tzw. osteoid), na który składa się głównie kolagen typu I (95%), a w mniejszych ilościach białka niekolagenowe, tzw. GLU-proteiny (GLU-, gdyż zawierają reszty kwasu glutaminowego): osteokalcyna i osteopontyna. Po wytworzeniu, komponent organiczny ulega mineralizacji, tj. wysyceniu solami mineralnymi wapnia, fosforu i magnezu. W ten sposób drugi komponent macierzy – nieorganiczny – niejako nakłada się na organiczny, dzięki czemu osteoid nabiera cech kompozytu.
Kompozyt zwykle przejawia własności, których nie posiada każdy z jego elementów z osobna. Np. pierwszy z wynalezionych przez człowieka kompozytów – cegła z gliny i słomy – jest o niebo trwalsza niż słoma i o niebo mniej krucha niż glina. Podobnie jest z kośćmi: komponent organiczny daje mu elastyczność, a mineralny – twardość.
Głównym składnikiem komponentu mineralnego jest hydroksyfosforan wapnia, zwany też hydroksyapatytem – zapisywany jako Ca10(PO4)6(OH)2 – który ma postać mikrofibryl, czyli bardzo długich kryształów (dł/szer = 1000/1).
Osteoblasty kontrolują mineralizację poprzez regulację przemieszczania się jonów wapniowych i fosforanowych przez ich błony komórkowe. Błony te zawierają fosfatazę alkaliczną, która bierze udział w wytwarzaniu jonów fosforanowych z fosforanów organicznych. Przypuszcza się, że produkowane przez osteoblasty białka niekolagenowe, takie jak osteopontyna, stanowią jądra kondensacji, gdyż zawierają całe pasma aminokwasów wiążących wapń, co może stanowić rusztowanie dla mineralzacji.
Podczas otaczania się osteoidem który ulega mineralizacji, osteoblasty ‘grzęzną w nim’, zamieniając się w osteocyty.
2. Osteocyty kontaktują się ze sobą poprzez wypustki cytoplazmatyczne leżące w kanalikach kostnych. Ich rolą jest wymiana substancji odżywczych i metabolitów kości. Są komórkami długo żyjącymi, gdyż przeciętny ich okres półtrwania wynosi 25 lat.
3. Osteoklasty (komórki kościogubne) – mają zdolność rozpuszczania i resorpcji tkanki kostnej. Są to komórki wielojądrzaste, powstałe w wyniku fuzji wielu komórek (wywodzą się z niezróżnicowanych komórek pnia układu krwiotwórczego). Osteoklasty upłynniają oba komponenty macierzy kostnej: uwalniają kwaśne proteazy trawiące kolagen, a za pomocą ATP-azy H+ – pompują do macierzy jony wodorowe, które rozpuszczają hydroksyapatyty.
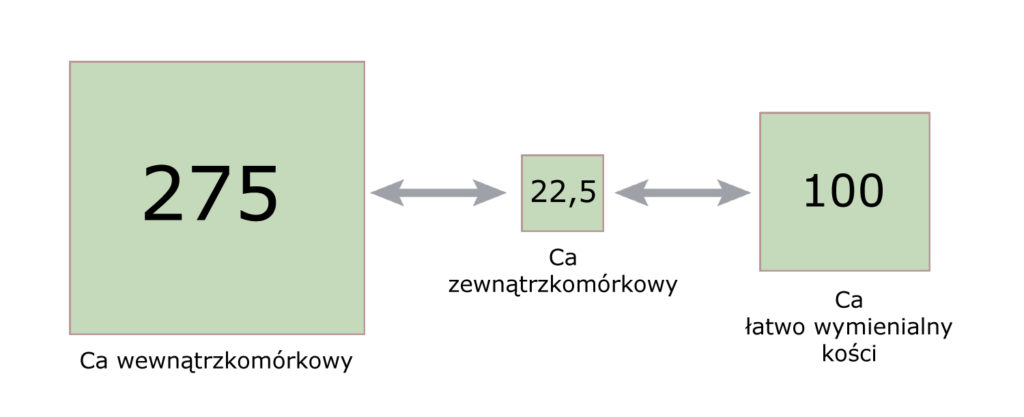
Jak wspomniałem, tkanka kostna zawiera 99% wapnia organizmu. Jest ona tworem dynamicznym. W małej części ulega ciągłej przebudowie: nieustannie zachodzą tu procesy tworzenia macierzy kostnej i rozpuszczania jej. Pomimo iż większość wapnia jest związana w blaszkach kostnych w postaci hydroksyapatytów (pula niewymienialna) – równowartość 1/250 tej ilości stanowi pulę łatwo wymienialną z osoczem. Dzięki temu możliwe jest buforowanie poziomu wapnia w płynach ustrojowych; ta regulacja ma do swojej dyspozycji ~100 mmoli cząsteczek Ca2+.
Biorąc pod uwagę to, że w płynach zewnątrzkomórkowych znajduje się 22,5 mmola cząsteczek Ca2+ – pula łatwo wymienialna kości jest ponad 4-krotnie większa od puli zewnątrzkomórkowej. Szacuje się, że w ciągu doby pomiędzy osoczem a kośćmi może wymienić się (łącznie w obie strony) nawet 500 mmoli Ca2+.
Zestawmy to z pulą wewnątrzkomórkową (275 mmoli Ca2+) i spójrzmy na proporcje:
* *
Nerki
W warunkach zbilansowanej gospodarki wapniowej nerki wydalają tyle wapnia ile wchłania się z przewodu pokarmowego, a może odwrotnie: w jelitach wchłania się tyle wapnia, ile wydaliły nerki: ~2,5 mmola/dobę. (Oczywiście pomijam tu okres ciąży, karmienia i wzrostu człowieczków, kiedy to – fizjologicznie – równowaga przesunięta jest w stronę budowy szkieletu, a więc gromadzenia wapnia i fosforanów.)
W ciągu doby przesączaniu kłębuszkowemu ulega aż 250 mmoli wapnia, gdyż osocze wielokrotnie w ciągu dnia przepływa przez nerkę. Jednakże znakomita większość jonów wapnia ulega resorpcji zwrotnej (głównie w kanalikach bliższych), tak więc wydalamy z moczem zaledwie 1/100 tej ilości wapnia, która uległa filtracji.
Problemem staje się zwiększone wydalanie wapnia, mogące prowadzić do kamieni moczowych i osteoporozy.
Zwiększenie wydalania wapnia może być efektem zwiększonej konsumpcji soli (a więc sodu). Sód – osmotycznie – ‘wsysa’ wodę do przestrzeni zewnątrzkomórkowej, co zwiększa jej objętość. Chcąc się pozbyć nadmiaru płynów zewnątrzkomórkowych (wraz z sodem) – nerka zwiększa filtrację kłębuszkową, przy czym hamuje resorpcję zwrotną sodu w kanalikach bliższych – a przy okazji hamuje też resorpcję wapnia.
W tym wypadku gospodarka wapniowa niejako ‘obrywa rykoszetem’ od przesolonej kuchni. Nie znalazłem jeszcze opisu mechanizmu, który za to odpowiada, ale podobna sytuacja, tj zwiększone wydalanie wapnia, występuje również przy nadmiernej konsumpcji glukozy. Czyli – nie tylko sól, ale i cukier… Nadmierne wydalanie wapnia pojawia się też przy kwasicy metabolicznej oraz nadmiernym spożywaniu białek, szczególnie zwierzęcych. O dziwo – podobne działanie ma też nadmiar… kofeiny.
Ech, gdyby nie ta kofeina – mielibyśmy wzorcowy konflikt ze śmieciowym żarciem: nadmiar tłuszczów upośledza wchłanianie Ca2+ w jelicie, a nadmiar soli, cukru i zwierzęcego białka – zwiększa utratę Ca2+ z moczem.
Wydalanie, a więc standardowa funkcja nerki – nie jest jedyną rolą, jaką spełnia ona w metabolizmie Ca2+. Dużo ciekawsze jest jej hormonalne posłannictwo, będące ważną częścią regulacji homeostazy wapniowej.
Przejdźmy więc do regulacji.
* *
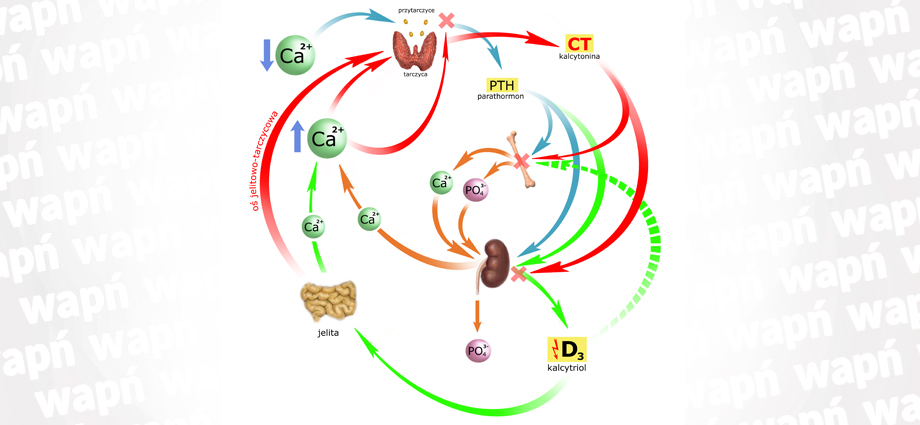
Regulacja Stężenia Wapnia
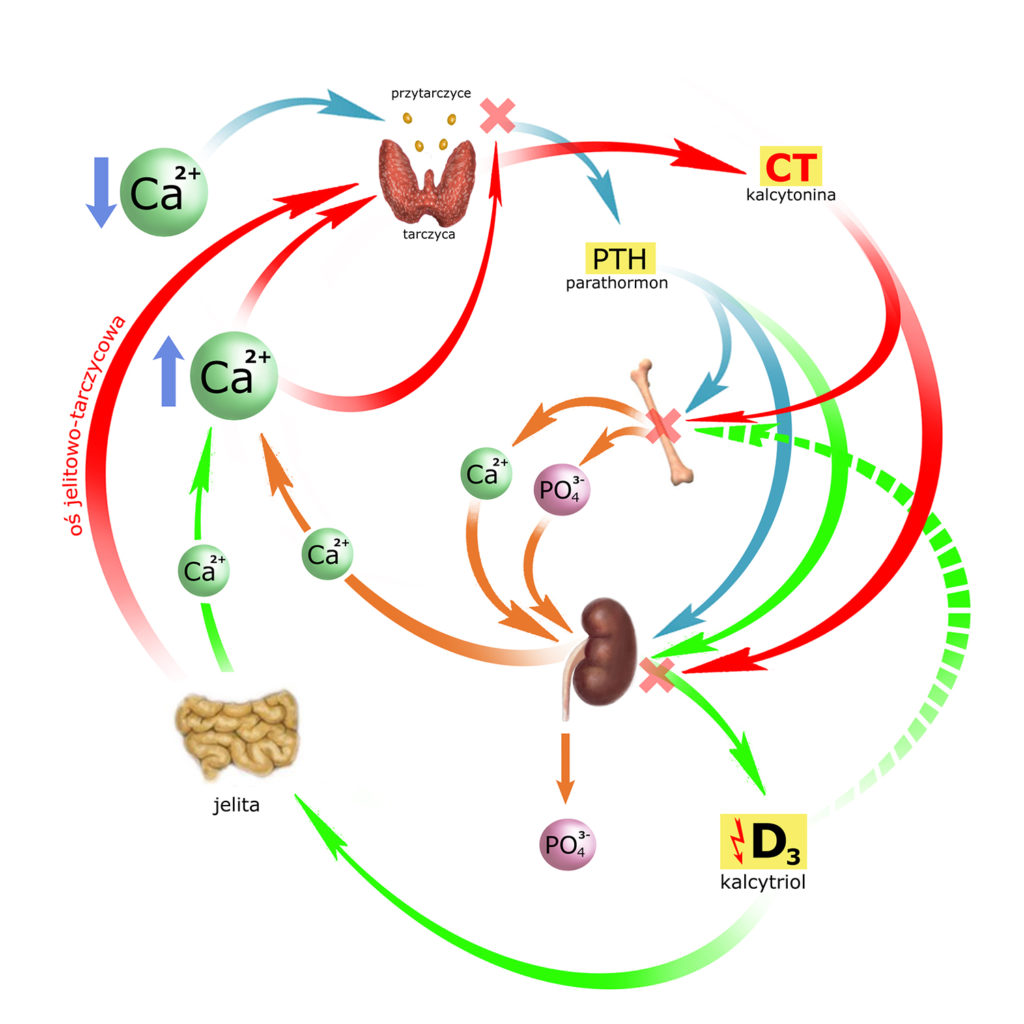
Omówię ją w trybie ilustrowanej opowieści, uzupełniając obrazek kolejnymi elementami fabuły, której bohaterem będzie wapń (i jego poziom we krwi).
Wyobraźmy sobie, że poziom wapnia we krwi spadł. Nie ma znaczenia, czy powodem tego był niedobór dostawy, nadmiar wydalania czy jakakolwiek inna przyczyna. Fakt jest faktem: stężenie wapnia jest zbyt niskie. Zapiszę to symbolem wapnia ze strzałką w dół.
Stężenie wapnia w osoczu monitorowane jest przez ‘przytarczyce’ (gruczoły przytarczyczne). Przytarczyc jest cztery; zlokalizowane są tuż za tarczycą, przylegając do jej tylnej ściany.
Komórki główne przytarczyc produkują parathormon (PTH) – polipeptyd będący hormonem, czyli substancją mającą właściwości oddziaływania na inne tkanki (i przedostającą się do tych tkanek drogą krwi). Produkcja PTH trwa nieustannie, a gromadzi się on w ziarnistościach hormonalnych komórek głównych.
I tu ma miejsce dość dziwne (@_@) zjawisko:
Otóż w ziarnistościach komórek głównych zmagazynowana jest tylko nieznaczna część PTH. Komórki główne przytarczyc produkują PTH w ogromnym nadmiarze (!), a jednocześnie są niebywale czułe na zmiany stężenia Ca2+ w osoczu. Prowadzi to do sytuacji, że nawet 90% PTH może ulec rozpadowi już w miejscu swojego powstania – jeśli stężenie Ca2+ w osoczu się podniesie.
Zachodzi tu relacja sprzężenia zwrotnego:
– spadek stężenia Ca2+ w osoczu – wzrost uwalniania PTH do osocza
– wzrost stężenia Ca2+ w osoczu – spadek uwalniania PTH do osocza (z powodu wzrostu rozpadu PTH w miejscu swojego powstawania).
Zauważ (!):
Sytuacja wygląda tak, jakby PTH był produkowany zawsze (i to w nadmiarze), a jego uwalnianie do krwi było modulowane poprzez stężenie Ca2+ jedynie na poziomie szybkości rozpadu nowo powstających cząstek hormonu.
Stężenie Ca2+ wyższe od pożądanego nie zatrzymuje produkcji parathormonu, tylko generuje jego rozpad in statu nascendi (w miejscu narodzin) – rozpad o nasileniu proporcjonalnym do zwiększającego się stężenia Ca2+.
Tak więc:
Spadek stężenia wapnia w osoczu wywołuje uwalnianie PTH do krwiobiegu:
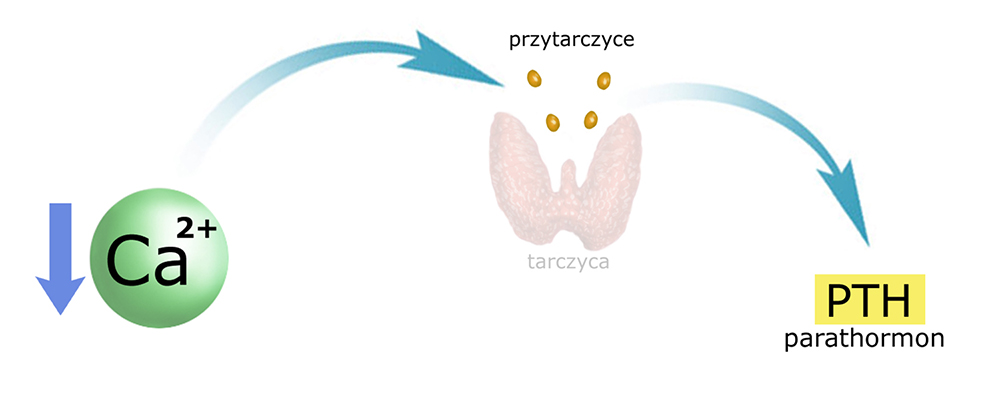
Cel (i istotę) działania PTH można przedstawić następująco:
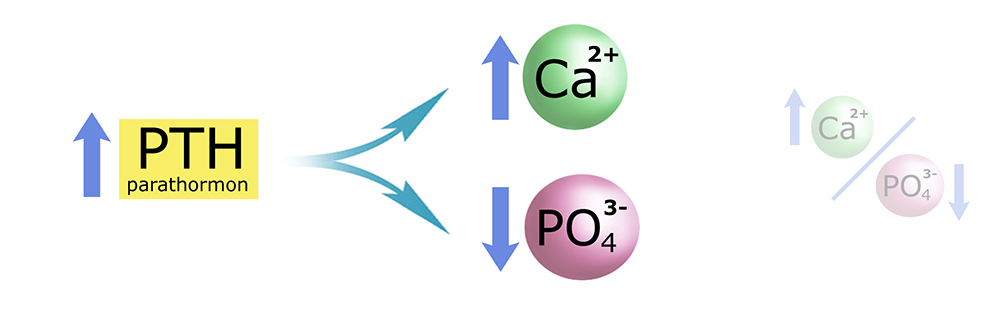
Spadek stężenia wapnia jest zaburzeniem proporcji Ca/PO4 w osoczu – na niekorzyść wapnia. Parathormon przywraca prawidłowe proporcje (na obrazku poniżej ‘intencje’ PTH umieściłem pod strzałką): podnosi stężenie wapnia i (jednocześnie) obniża stężenie fosforanów.
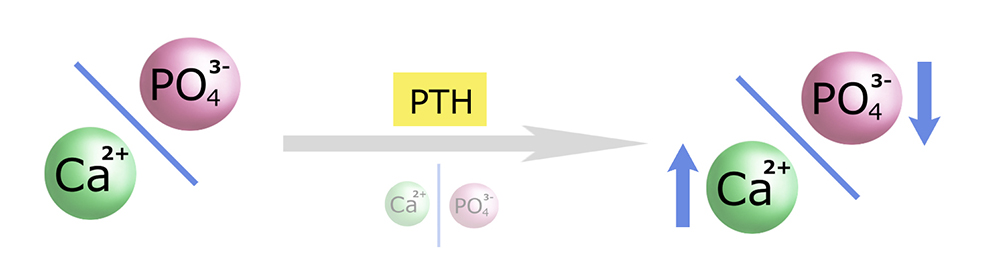
Warto pamiętać, że fosforany – prócz tego, że występują we krwi jako aniony małocząsteczkowe (m. in. w kompleksach z wapniem) – są też główną frakcją anionów wewnątrzkomórkowych. To bardzo ważna grupa jonów, której zwykle poświęca się zbyt mało uwagi w podręcznikach.*
*) Tak, czepiam się, ale mam rację.
Obniżanie poziomu fosforanów jest jednym z dwóch kluczowych zadań parathormonu, a większość podręczników przytacza ten fakt bez wyjaśnienia. Zresztą – generalnie – metabolizm fosforanów traktowany jest ‘po macoszemu’ i nie miewa oddzielnych opracowań, a wzmianki o nim wtłaczane są na siłę w końcówki akapitów opisujących wapń. Aby mieć alibi, umieszcza się tylko słowo ‘fosforany’ w tytule (np. ‘Metabolizm wapniowo-fosforanowy’), po czym 99% tekstu odnosi się do wapnia.
W jaki sposób PTH wywiązuje się ze swojego zadania?
Działa wielotorowo – poprzez wszystkie trzy ogniwa: kości, jelita i nerki.
Zacznijmy od kości. Tu bezpośrednie działanie PTH można podzielić na 2 fazy.
Pierwsza z nich (po 3-4 godz.) to działanie na osteocyty. Stają się one bardziej przepuszczalne dla jonów Ca2+ (obecnych w macierzy kostnej), które wnikają do cytozolu, a stąd dalej do płynu zewnątrzkomórkowego i osocza. Ten ‘wychwyt’ jonów Ca2+ przesuwa równowagę w kierunku rozpuszczania kryształów hydroksyapatytów.
Faza druga (po ~12 godz.) to aktywacja osteoklastów, które przystępują do resorpcji macierzy kostnej. Za pomocą enzymów (kolagenaza) rozpuszczają strukturę organiczną osteoidu, natomiast za pomocą kwasów (mlekowy, cytrynowy, węglowy) – strukturę mineralną.
Uwaga (!)
W fazie drugiej PTH aktywuje nie tylko osteoklasty (kościogubne), ale i osteoblasty (komórki kościotwórcze). Prowadzi to do sytuacji zwiększonego metabolizmu tkanki kostnej: jednocześnie zachodzą procesy rozpuszczania i tworzenia osteoidu. Mechanizm ten omówię nieco później, gdyż bierze w nim udział też inny z hormonów (kalcytriol).
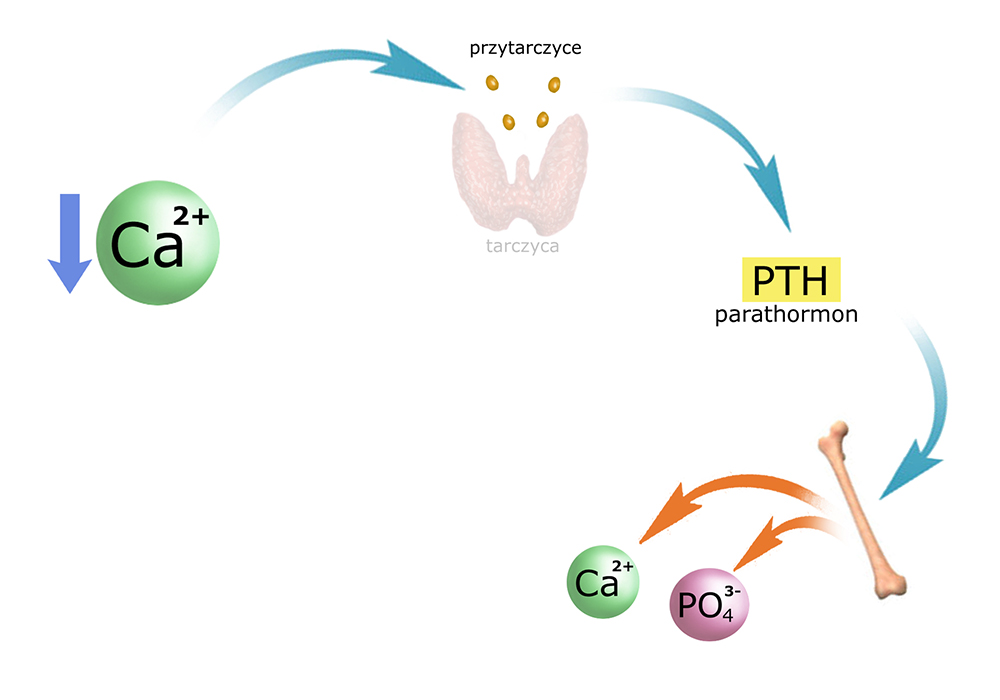
Produktami rozpuszczania hydroksyapatytów (hydroksy-fosforanów wapnia) są i kationy wapnia i aniony fosforanowe, które pojawiają się we krwi. Aby przywrócić właściwe proporcje Ca/PO4, parathormon wywiera wpływ na kanaliki nerkowe:
– hamuje resorpcję zwrotną fosforanów (pozwalając im przedostawać się do moczu, a więc zwiększając ich wydalanie)
– nasila resorpcję zwrotną wapnia (w kanalikach dalszych, gdyż w bliższych Ca2+ i tak jest wchłaniany – o ile konieczność wydalania nadmiarów sodu nie blokuje tej drogi).
Uzupełnijmy obrazek:
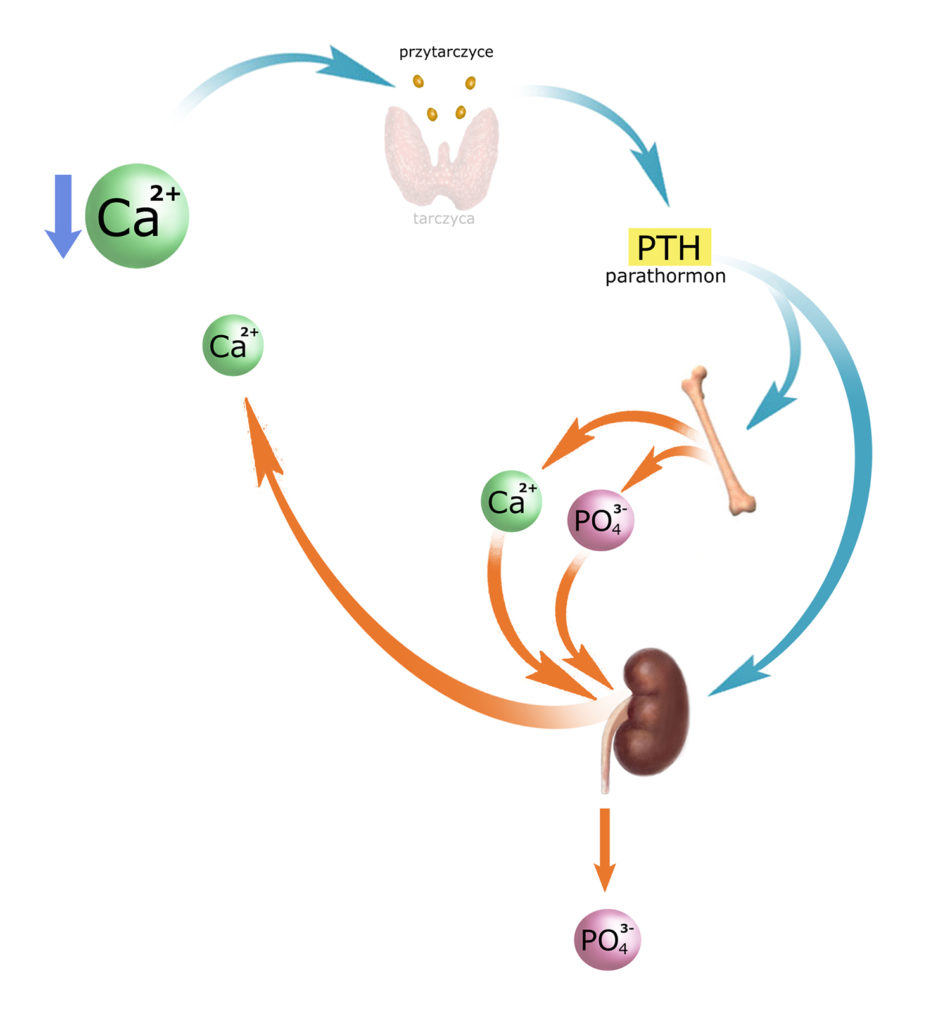
Na marginesie – ważna uwaga (!):
Zwiększona ilość wapnia we krwi (będąca efektem działania PTH) może przekroczyć pojemność resorpcyjną kanalików dalszych, a więc ilość wapnia wydalanego z moczem może się tymczasowo zwiększyć. Jednak resorpcja wapnia następuje i proporcje Ca/PO4 są przywracane.
Oba powyżej opisane działania PTH były wpływem bezpośrednim. Parathormon wywiera jednak również wpływ pośredni – poprzez kontrolę wytwarzania aktywnej postaci witaminy D w nerkach. Zanim przejdziemy do sedna – zwięzłe przypomnienie perypetii witaminy D:
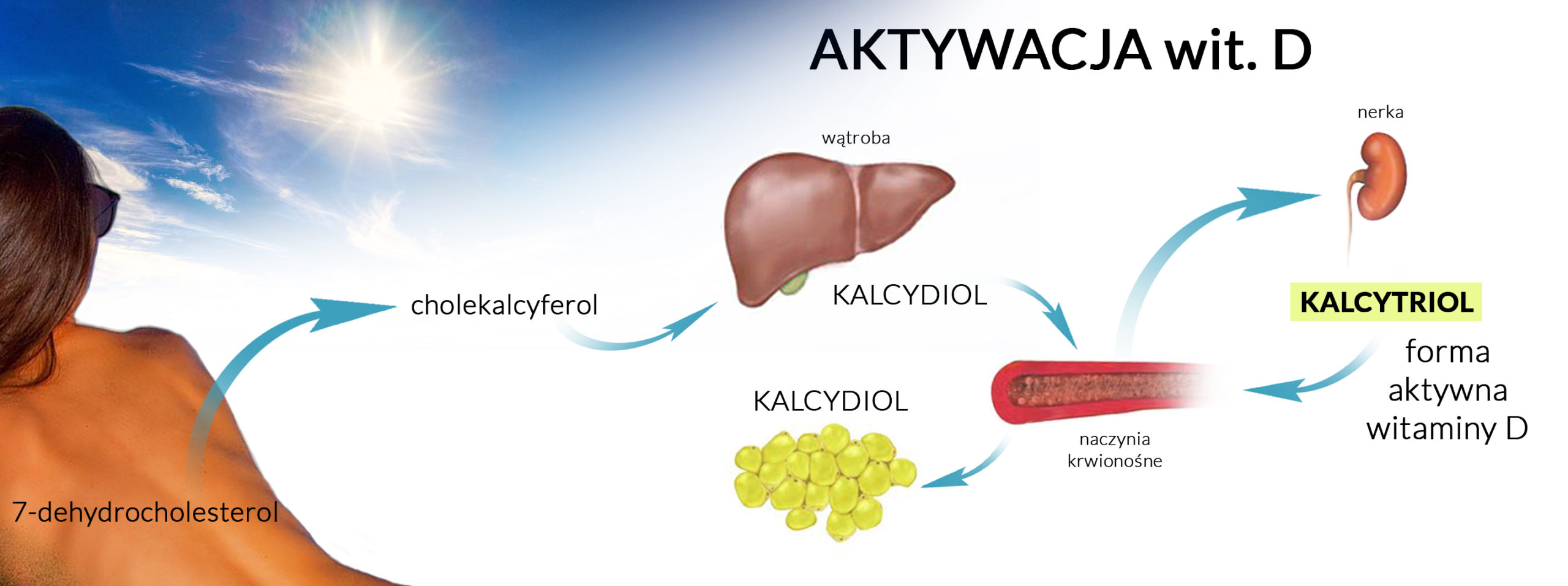
Prowitaminę D3 (7-dehydrocholesterol) produkuje nasza skóra z cholesterolu (fibroblasty skóry są jednymi z nielicznych komórek naszego organizmu zdolnymi do degradowania kompleksów LDL). Pod wpływem promieniowania ultrafioletowego prowitamina ulega izomeryzacji do prewitaminy – a ta pod wpływem ciepła organizmu po kilku godzinach zamienia się w witaminę D3, czyli cholekalcyferol. Witamina transportowana jest do wątroby, gdzie ulega zamianie na 25(OH)D3 (kalcydiol), będący formą magazynową witaminy – uznawaną za prohormon. Drogą krwi dostaje się do nerki, gdzie w kanalikach bliższych – TYLKO W OBECNOŚCI PTH – zmienia się w kalcytriol (1,25(OH)2D3), czyli aktywną (supernaładowaną) postać witaminy D3.
Wytwarzanie kalcytriolu w nerkach kontrolowane jest na zasadzie ujemnego sprzężenia zwrotnego – przez sam kalcytriol (jego nadmiar natychmiast wstrzymuje produkcję.)
Kalcytriol oddziałuje na nabłonek jelitowy – zwiększając wchłanianie wapnia.*
*) Kalcytriol wnika do enterocytów i poprzez receptory wewnątrzkomórkowe uruchamia produkcję kilku białek, m.in. ATP-azy Ca2+ i cytozolowego DBP (białka, z którym kalcytriol łączy się wewnątrz komórki). DBP zwiększa przepuszczalność błony komórkowej dla Ca2+ i pobudza aktywność ATP-azy Ca2+. Dzięki temu wapń jest pompowany z wnętrza enterocytu do osocza. Jednocześnie DBP transportuje wapń wewnątrz komórki (wiąże jony Ca2+), przez co pomiędzy światłem jelita a cytoplazmą enterocytu powstaje korzystny dla jonów wapnia gradient stężeń.
Uzupełnijmy obrazek o pierwszy z mechanizmów działania kalcytriolu (strzałki zielone).

Warto zauważyć, że kalcytriol zwiększa też wchłanianie fosforanów (!).
Nie ma w tym nic dziwnego, gdyż przecież witamina D3 najbardziej znana jest z tego, że ”buduje kości”, a te potrzebują i wapna i fosforanów.
Tak (!) – drugim celem kalcytriolu są kości. Jego mechanizm działania określa się tu jako ‘permisyjny’ w stosunku do PTH, a więc – ułatwia działanie parathormonu. (Ilekroć działa PTH, działa też kalcytriol, gdyż jest on przecież efektem wpływu PTH na nerkę.)
Wspomniałem wcześniej, że działanie PTH na kości polega na równoczesnej aktywacji komórek kościogubnych (osteoklastów) i kościotwórczych (osteoblastów). Ułatwianie działania parathormonowi polega na tym, że kalcytriol zwiększa aktywność obu typów komórek, działając na ich receptory.
Uzupełnijmy obrazek (strzałka przerywana):
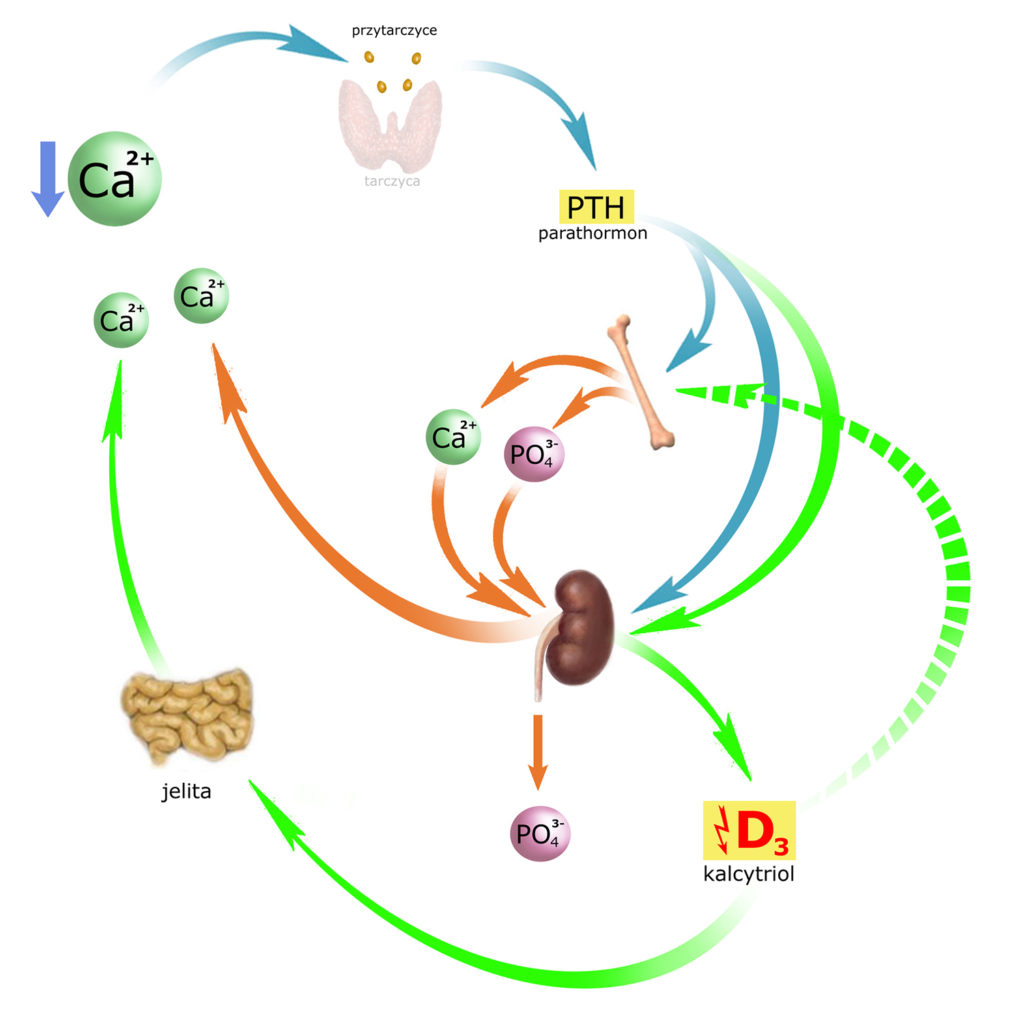
Spróbujmy zrozumieć dlaczego tak się dzieje, tj. dlaczego PTH + kalcytriol aktywują wszystkie typy komórek kostnych (bo przecież w pierwszej fazie aktywacji parathormon uruchamia też osteocyty). Dzieje się tak, gdyż w dużej mierze mineralizacja kości jest procesem spontanicznym. Zachodzi samoistnie wtedy, gdy stężenia Ca2+ i PO43- są odpowiednio wysokie – decyduje o tym tzw. iloczyn rozpuszczalności. Proces odwrotny – demineralizacja kości – zachodzi równie spontanicznie, jeśli zajdą odpowiednie warunki. Np. jeśli stężenie wapnia jest zbyt małe – iloczyn rozpuszczalności spada i równowaga przesuwa się w kierunku ‘upłynniania’ kryształów hydroksyapatytu.
Generalnie:
– pH alkaliczne sprzyja mineralizacji kości i budowie osteoidu (alkaliczne fosfatazy oddzielają fosforany od ich estrów, przez co rośnie stężenie PO43-, więc możliwa jest wytrącanie fosforanu wapnia). Taka aktywność jest charakterystyczna dla osteoblastów, które tworzą też kolagen macierzy.
– pH kwasowe sprzyja demineralizacji kości i rozpuszczaniu osteoidu (kwaśne proteazy trawią kolagen, ATP-azy H+ pompują jony wodorowe, które rozpuszczają kryształy hydroksyapatytu). Z tej aktywności słyną osteoklasty.
Zauważ, że zarówno mineralizacja jak i demineralizacja wymagają ekspozycji na zmienne warunki otoczenia – i właśnie tym jest aktywacja komórek. Macierz tkanki kostnej komunikuje się z przestrzenią pozakomórkową jedynie poprzez cytoplazmę komórek kości. Cytoplazmy aktywowanych osteocytów są bardziej przepuszczalne dla jonów – stanowią więc jakby płynny pomost pomiędzy osoczem krwi a macierzą kości.
Jeśli teraz w środowisku zewnątrzkomórkowym dominowało będzie zakwaszenie, to – poprzez cytoplazmy aktywowanych (przez PTH) komórek – zmniejszone pH oddziaływać też będzie na macierz kostną: przewagę uzyska demineralizacja / rozpuszczanie. Kiedy zakwaszenie ustąpi – przewaga będzie po stronie procesów kreacji i mineralizacji.
*) Jak dla mnie – trochę to przypomina zabawę z woskiem i świecą. Bez względu na to, czy chcesz ująć trochę wosku ze świecy czy jej go trochę dodać – najlepiej świecę wcześniej roztopić. Trochę tak właśnie działa tandem PTH + kalcytriol – jak ‘płomień’ rozpuszczający kości. Dzięki temu – organizmowi łatwiej kości budować (dolewając wapnia i fosforanów) lub z nich czerpać – pobierając wapń (i pozbywając się nadmiaru fosforanów z moczem).
* *
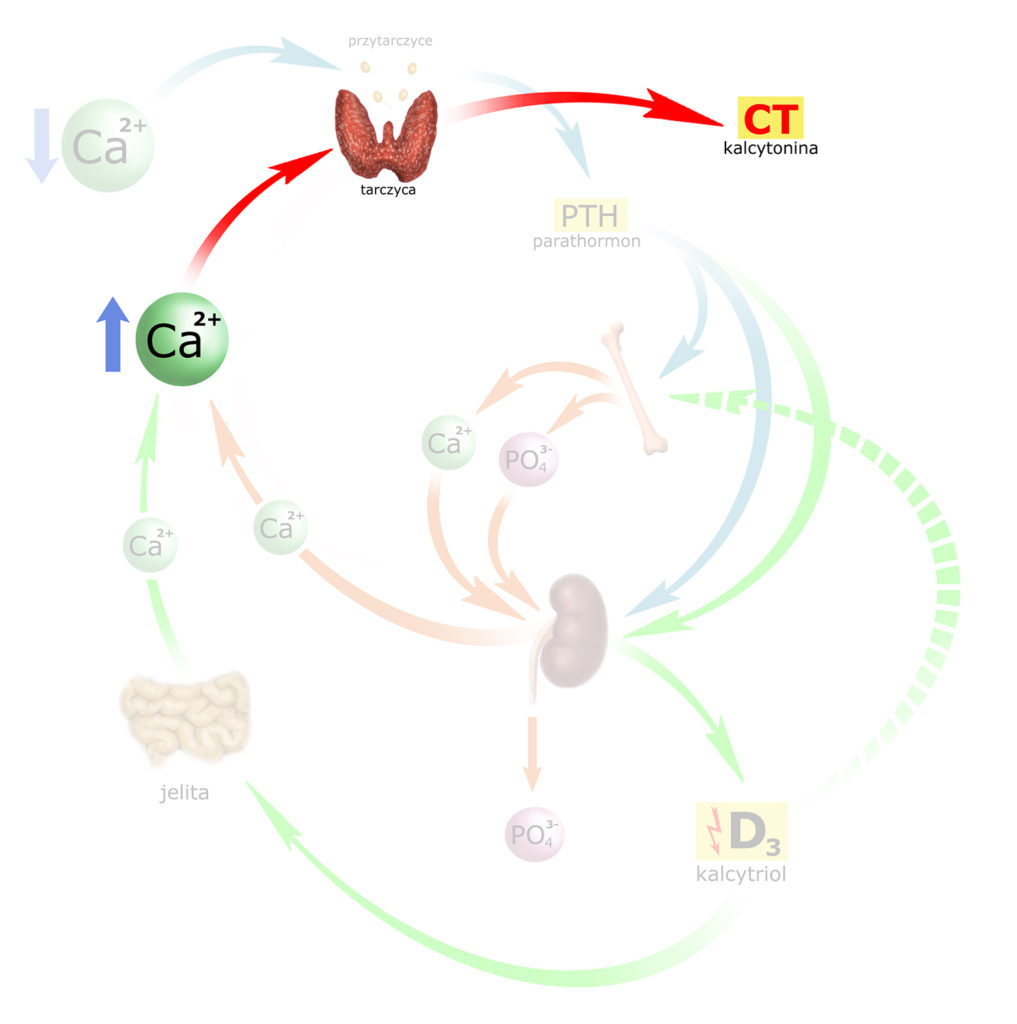
Kalcytonina
Efektem działania PTH i kalcytriolu jest podniesienie stężenia wapnia we krwi. Gdy stężenie to przekracza 2,5 mmol/l – jony Ca2+ osocza zaczynają bezpośrednio oddziaływać na komórki przypęcherzykowe ‘C’ gruczołu tarczowego, które uwalniają kalcytoninę (CT). Wydzielanie kalcytoniny przez tarczycę regulowane jest mechanizmem ujemnego sprzężenia zwrotnego: im wyższe stężenie wapnia – tym większe uwalnianie CT, natomiast mniejsze stężenia wapnia – hamują wydzielanie CT.
Wzbogaćmy obrazek o ten element. ‘Fabułę’ naszych poprzednich obserwacji wrzucę w tło, aby nie przeszkadzała w analizie mechanizmów, których nasz organizm używa do zmniejszania stężenia wapnia:
I teraz – uwaga (!)
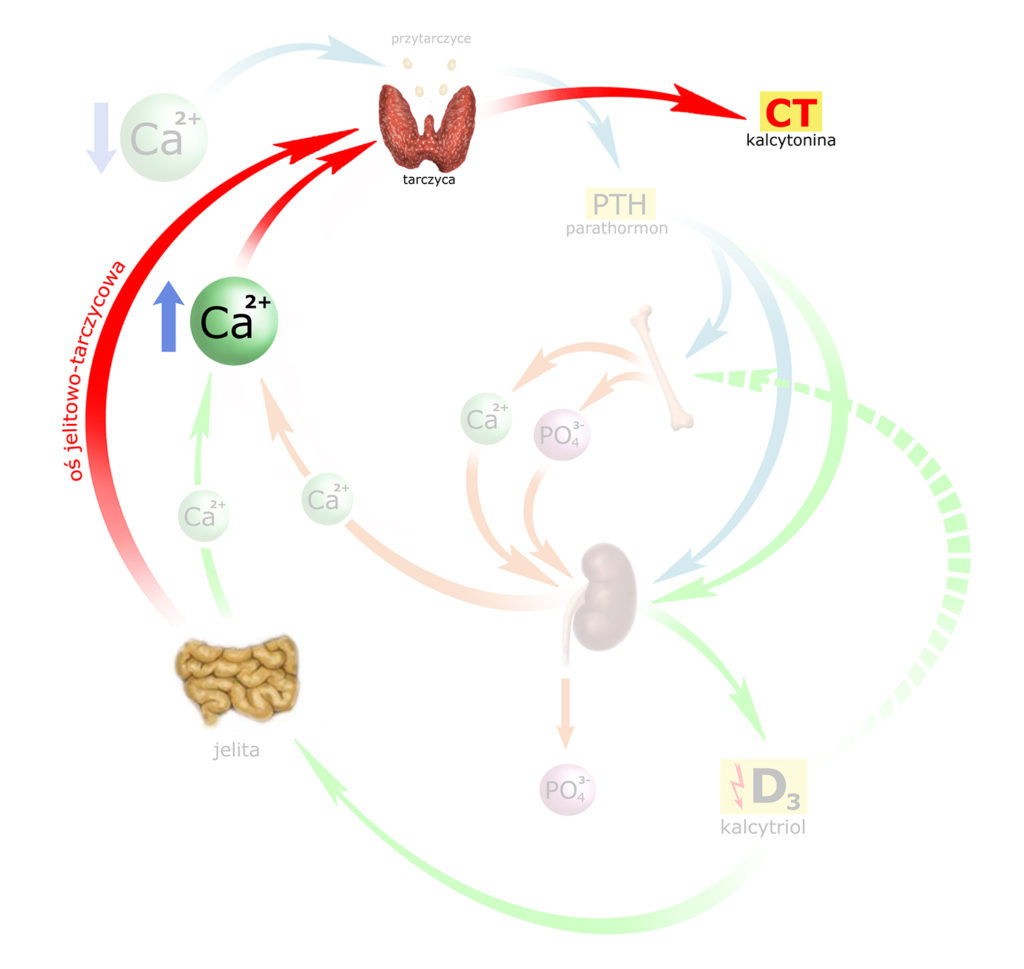
Zanim przyjrzymy się punktom oddziaływania CT musimy uwzględnić dodatkowy element, a mianowicie tzw. oś jelitowo-tarczycową.
Tuż po przyjęciu pokarmu, gdy rozpoczyna się trawienie – wzmaga się wydzielanie hormonów żołądkowo-jelitowych: gastryny, cholecystokininy, sekretyny i glukagonu. Mniej więcej w tym samym czasie rusza wchłanianie wapnia z jelita do krwi, co mogłoby pociągnąć gwałtowny wzrost stężenia wapnia w osoczu. Oś jelitowo-tarczycowa czuwa właśnie nad tym, aby ten wzrost nie był zbyt gwałtowny: wymienione wyżej hormony – głównie gastryna – pobudzają wydzielanie CT przez tarczycę (a CT zwrotnie hamuje wydzielanie gastryny i żołądkową sekrecję HCl).
Zaznaczmy to na obrazku:
W jaki sposób kalcytonina zmniejsza stężenie wapnia? Poprzez dwa punkty oddziaływania, przy czym w obu przypadkach jej wpływ jest antagonistyczny w stosunku do PTH:
– KOŚCI: CT hamuje aktywność komórek kości, przy czym najsilniej działa na receptory osteoklastów (hamowanie syntezy enzymów lizosomalnych i procesów resorpcji macierzy kostnej); wtórnie CT pobudza osteoblasty i procesy budowy osteoidu.
– NERKI: CT hamuje wytwarzanie aktywnej postaci wit. D3 (kalcytriolu)
Na koniec, przypomnijmy sobie jeszcze w jaki sposób poziom wapnia działa na przytarczyce: PTH produkowany jest zawsze, natomiast jego rozpad jest proporcjonalny do stężenia Ca2+ w osoczu. A więc wysokie stężenie wapnia – zahamuje uwalnianie PTH (zwiększając rozpad PTH in statu nascendi). Również i tę relację umieśćmy na obrazku:
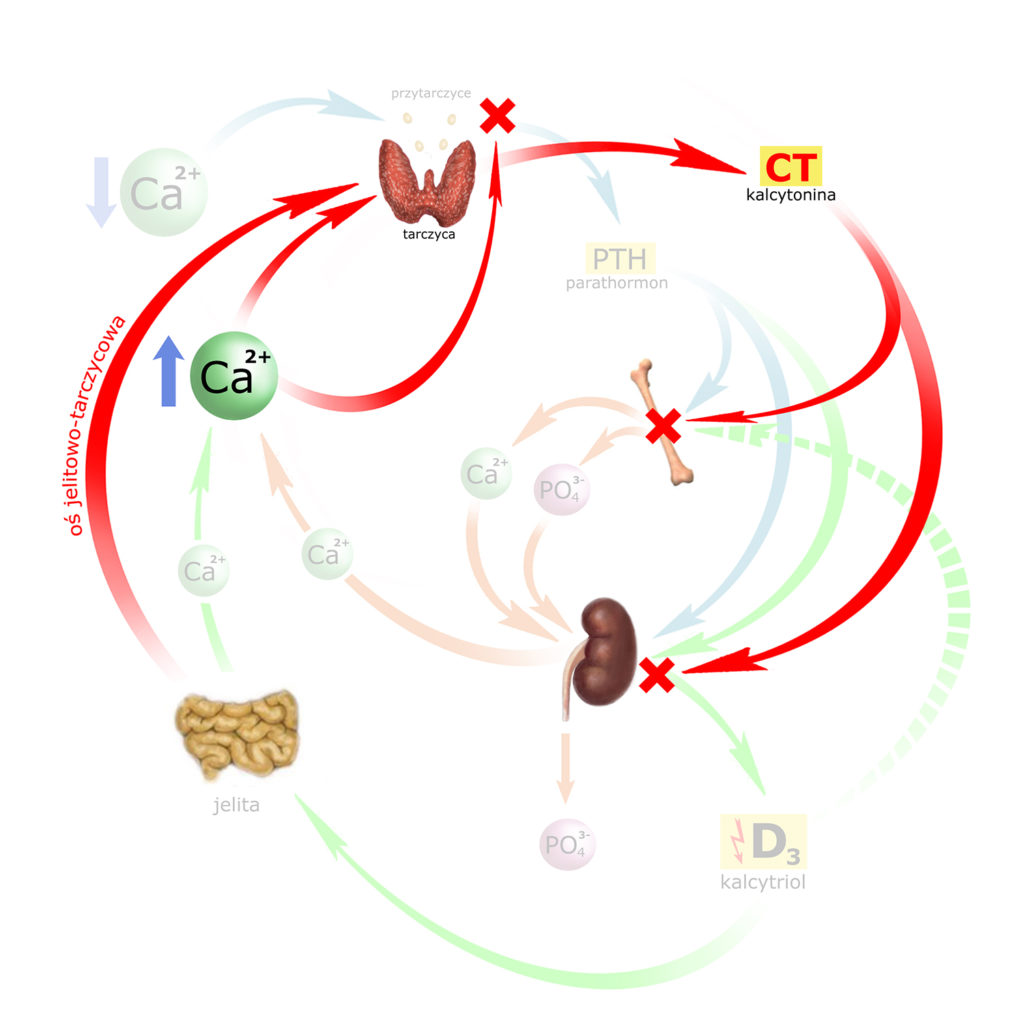
Podsumujmy przeciwdziałania organizmu przed zbytnim wzrostem stężenia wapnia:
Już w chwili przyjmowania pożywienia oś jelitowo-tarczycowa przygotowuje nas do zbliżającego się wzrostu poziomu wapnia we krwi – stymulując uwalnianie CT przez tarczycę. Kiedy rozpoczyna się trawienie, rosnące stężenie wapnia w osoczu – dołącza się do stymulowania uwalniania CT, jednocześnie blokując wydzielanie PTH przez przytarczyce.
PTH nie jest więc już wydzielany, a jego wcześniejsze wpływy na kości i nerkę – znosi nowo uwolniona kalcytonina (CT).
* *
Uff..
Dopiero teraz możemy ze spokojem spojrzeć na (w miarę kompletny) schemat regulacji stężenia wapnia we krwi.
W kolejnych opracowaniach przyjrzymy się innym ważnym regulacjom homeostatycznym. Dopóki tego nie zrobimy – nie będziemy w stanie zrozumieć jak działa nasz organizm i DLACZEGO działa właśnie tak.